Combinación de enfoques epigenéticos y metabólicos para el tratamiento específico del cáncer
Las mutaciones que alteran el estado epigenético de las enzimas modificadoras de la cromatina son una característica de las enfermedades humanas, incluidos muchos tipos de cáncer.
Las mutaciones en un conjunto de genes conocidos como la familia del COMplejo de Proteínas Asociadas a Set1 (COMPASS), concretamente las mutaciones en los genes MLL3 y MLL4, son frecuentes en pacientes con muchos tipos de cáncer.
Para comprender mejor estos genes y qué papel desempeñan en el crecimiento tumoral, investigadores del Departamento de Bioquímica y Genética Molecular, Facultad de Medicina Feinberg de la Universidad Northwestern, Chicago, Estados Unidos realizaron un cribado CRISPR en células madre embrionarias de ratones con MLL3 y MLL4 eliminados. Según el estudio, las células con MLL3 y MLL4 eliminados parecían aumentar la producción de purina, un componente esencial del ADN y el ARN.
Para ver si podían frenarse con una táctica similar, los investigadores probaron su método en células de pacientes con cáncer colorrectal. Según el estudio, descubrieron que las células con mutaciones eran más sensibles al inhibidor de la síntesis de purinas que las que expresaban MLL4 silvestre.
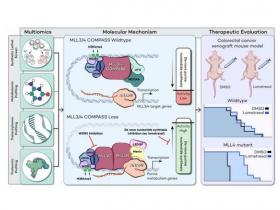
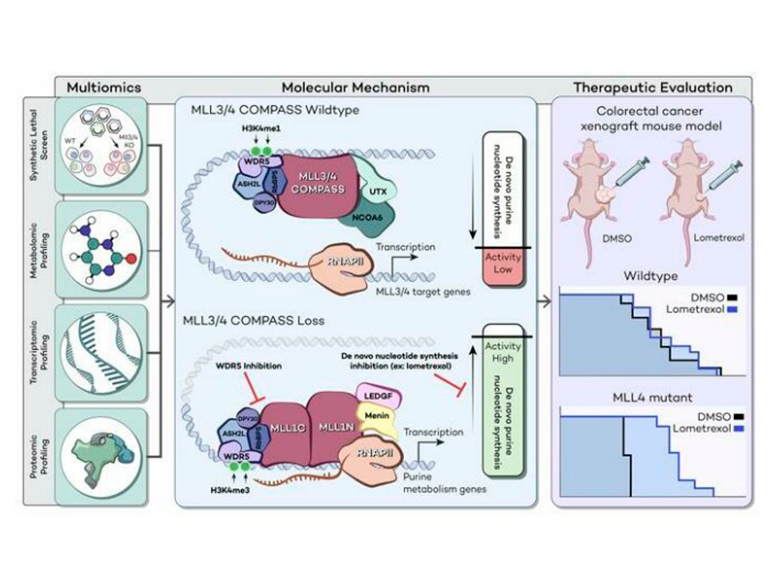
El cribado CRISPR en células madre embrionarias de ratón (mESCs) deplecionadas de MLL3/4 reveló letalidad sintética tras la supresión de las vías de síntesis de nucleótidos de purina y pirimidina. De forma consistente, se observó un cambio en la actividad metabólica hacia un aumento de la síntesis de purina en mESCs MLL3/4 knockout (KO). Estas células también mostraron una mayor sensibilidad al inhibidor de la síntesis de purinas lometrexol, que indujo una firma de expresión génica única.
La secuenciación del ARN identificó los principales genes diana de MLL3/4 que coinciden con la supresión del metabolismo de las purinas, y el perfil proteómico de tandem mass tag (TMT) confirmó aún más la regulación al alza de la síntesis de purinas en las células MLL3/4 KO. Mecánicamente, la compensación por MLL1/COMPASS subyacía a estos efectos.
Finalmente, se demostró que los tumores con mutaciones en MLL3 y/o MLL4 eran altamente sensibles al lometrexol in vivo, tanto en cultivo como en modelos animales de cáncer. Los resultados describen una dependencia metabólica dirigida que surge de la deficiencia del factor epigenético, proporcionando una visión molecular para informar la terapia de cánceres con alteraciones epigenéticas secundarias a la disfunción de MLL3/4 COMPASS.
El equipo espera pasar a estudios preclínicos para validar aún más la eficacia del enfoque.