Una microbiota frÃa para perder peso
Mediante un mecanismo que involucra cambios en la microbiota inducidos por exposiciÃģn al frÃo, ocurre un remodelamiento de la grasa blanca, la que sufre un proceso denominado pardeamiento. Esto conduce a una pÃĐrdida de masa adiposa, de calor y a una disminuciÃģn del peso en ratones, aumentando el nivel de sensibilidad a la insulina. Estas condiciones de temperatura, alteran la composiciÃģn y diversidad de microorganismos intestinales, provocando un gran aumento de la absorciÃģn nutricional, en directo beneficio del pardeamiento de la grasa blanca. Estos hallazgos evidencian que la remodelaciÃģn del tejido adiposo y la modificaciÃģn de la estructura intestinal se encuentran coordinadas bajo la exposiciÃģn al frÃo, siendo promovidas por alteraciones en el equilibrio dinÃĄmico de especies bacterianas del intestino. En un futuro, dada la accesibilidad de este Ãģrgano, se podrÃĄn orientar los enfoques terapÃĐuticos contra la obesidad y diabetes tipo 2, hacia la modulaciÃģn del tejido adiposo dependiente de la consistencia de una microbiota adaptada al frÃo. Â
Remodelamiento de tejido adiposo
Muchos de nosotros vivimos en un mundo donde la abundancia nutricional y la inactividad fÃsica son la norma. Tales condiciones son antecedentes para la obesidad, diabetes tipo 2 y dislipidemia. La alta prevalencia de estos trastornos y su implicancia en nuestra salud fÃsica, emocional y econÃģmica, han causado un gran interÃĐs y conllevado a una intensa investigaciÃģn sobre los mecanismos fisiolÃģgicos que subyacen al metabolismo. Recientemente, dos ÃĄreas que han llamado la atenciÃģn son la identificaciÃģn y manipulaciÃģn del tejido adiposo marrÃģn humano y el papel desempeÃąado por el microbioma intestinal en el balance energÃĐtico. Aunque estos dos ÃĄmbitos se han investigado por separado, los nuevos trabajos sugieren que existe una Ãntima relaciÃģn entre la microbiota intestinal y la capacidad de nuestros depÃģsitos de grasa de modificar su funciÃģn, pasando de un almacenamiento de calorÃas a una quema de energÃa.
Los mamÃferos tienen al menos dos tipos de tejido adiposo: el conocido (y muy abundante) tejido blanco que almacena calorÃas extra, y el tejido adiposo marrÃģn, el cual disipa energÃa a travÃĐs del desacoplamiento mitocondrial y la producciÃģn de calor. Un tercer tipo de cÃĐlula adiposa, el adipocito "beige", tiene la capacidad de transiciÃģn entre los estados de almacenamiento de energÃa y  disipaciÃģn.  Estas cÃĐlulas han sido objeto de un gran interÃĐs en la investigaciÃģn por su capacidad inherente de inducciÃģn y porque recientemente se han descubierto en humanos. Estudios en ratones han identificado varios moduladores de la apariciÃģn de cÃĐlulas adiposas beige en cÚmulos de grasa blanca, proceso conocido como "pardeamiento". El mÃĄs destacado entre estos factores moduladores, es la exposiciÃģn al frÃo, que funciona en parte, mediante la activaciÃģn central de vÃas simpÃĄticas y a travÃĐs de la producciÃģn local de catecolaminas por macrÃģfagos.
El oscurecimiento inducido por el frÃo puede promover una impresionante pÃĐrdida de peso en ratones, asà como mejoras en la sensibilidad a la insulina y reducciÃģn de la hiperlipidemia. Los beneficios metabÃģlicos del pardeamiento inducido por frÃo tambiÃĐn se han evidenciado en seres humanos. Sin embargo, las personas no disfrutan particularmente de las bajas temperaturas. Por otra parte, "el impedimento de la necesidad de exposiciÃģn al frÃo mediante la administraciÃģn de catecolaminas, es tan ineficaz como potencialmente daÃąino. Por lo tanto, se puede entender el impetu por identificar nuevos mecanismos que puedan ser explotados para inducir el pardeamiento de una manera segura y eficaz.
En un reciente estudio, Claire Chevalier y colegas (Cell. 2015 Dec 3;163(6):1360-74) identificaron una nueva e inesperada vÃa que vincula el microbioma intestinal con el oscurecimiento de la grasa blanca. El cuerpo humano contiene miles de millones de bacterias colonizadoras, con una densidad particularmente alta en el intestino grueso y delgado. Los avances en la tecnologÃa de secuenciaciÃģn a gran escala han permitido cuantificar la distribuciÃģn de especies bacterianas en el intestino y determinar cÃģmo se ve alterada por la dieta. AÚn mÃĄs importante, existe una creciente conciencia de que la composiciÃģn de la microbiota no sÃģlo refleja los cambios en el rÃĐgimen alimentario sino tambiÃĐn modula directamente la funciÃģn metabÃģlica del hospedero. Por lo tanto, la alteraciÃģn del ambiente microbiano a travÃĐs de tratamientos con antibiÃģticos o por la transferencia de gÃĐneros bacterianos especÃficos, pueden afectar el peso del cuerpo, asà como tambiÃĐn la sensibilidad a insulina, entre otras medidas metabÃģlicas. Sin embargo, ha sido poco claro como esto ocurre.
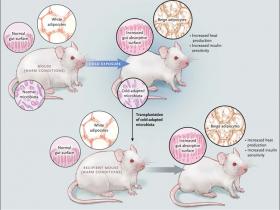
Este nuevo trabajo, muestra que la exposiciÃģn al frÃo, al igual que modificaciones en la dieta, provoca alteraciones en los microorganismos intestinales de ratones. Por otra parte, cuando la microbiota adaptada al frÃo se transfiere a otro ratÃģn libre de gÃĐrmenes, este animal receptor pierde masa adiposa y mejora su sensibilidad frente a la insulina, lo que estÃĄ provocado por un proceso que implica un potenciamiento del pardeamiento (fig. 1). En un hallazgo consistente con esta observaciÃģn, los ratones que reciben bacterias adaptadas al frÃo (frente a una microbiota "normal") son mÃĄs eficaces en defender su cuerpo al ser colocados en un ambiente de baja temperatura. Por lo tanto, la dieta no es el Único factor ambiental en ser monitoreado por el microbioma. AdemÃĄs, estos resultados sugieren que el efecto del frÃo sobre el reclutamiento de grasa beige puede darse en parte, por medio de modificaciones en la microbiota intestinal.
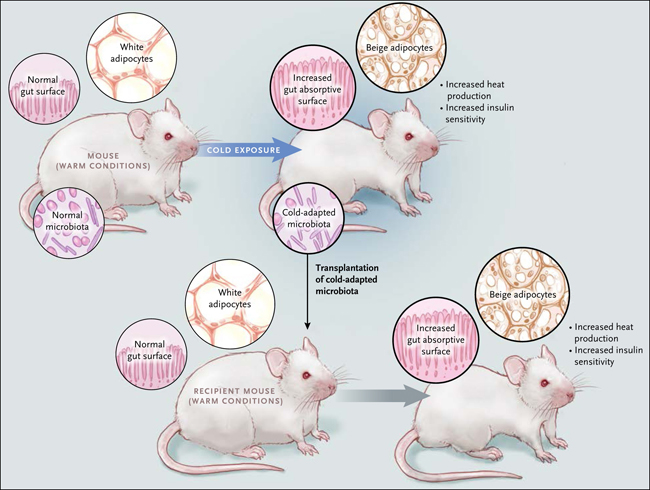
Figura 1. Procediendo del frÃo.Â
La exposiciÃģn al frÃo provoca el pardeamiento de la grasa blanca en ratones, aumentando la sensibilidad a la insulina y la producciÃģn de calor, ademÃĄs promueve una pÃĐrdida de peso. Claire Chevalier y sus colegas reportaron que la exposiciÃģn tambiÃĐn cambia la composiciÃģn de la microbiota intestinal y provoca un gran aumento en la superficie de absorciÃģn intestinal. El trasplante de la microbiota adaptada al frÃo, a partir de ratones bajo esas condiciones de temperatura, es suficiente para promover el pardeamiento, potenciar la sensibilidad a la insulina e incrementar el ÃĄrea de superficie intestinal, en ratones receptores en condiciones normales de temperatura.
La exposiciÃģn continua al frÃo no causa un desperdicio energÃĐtico para los animales. Se establece un nuevo equilibrio entre la pÃĐrdida y acrecentamiento de la grasa. Para proporcionar el combustible para la grasa marrÃģn altamente termogÃĐnica, este estado de equilibrio dinÃĄmico se caracteriza por el aumento de la ingesta de alimentos - el cual ciertamente se produce - y por una mÃĄs eficiente absorciÃģn de nutrientes. Esta investigaciÃģn muestra que la prolongaciÃģn a estas condiciones de frÃo, induce un masivo aumento de la superficie de absorciÃģn intestinal, en paralelo a la reducciÃģn de la apoptosis de cÃĐlulas que componen las microvellosidades. Como se mencionÃģ, este efecto podrÃa ser conseguido simplemente mediante el trasplante de una microbiota adaptada al frÃo hacia animales libres de microorganismos intestintales. Considerando esto, la remodelaciÃģn del intestino y del tejido adiposo estÃĄn coordinadas durante la exposiciÃģn y ambos procesos son promovidas por cambios en la microbiota. Por lo tanto, el intensificado oscurecimiento de la grasa blanca, que se da en primer lugar, para luego dar paso a un incremento de la  superficie de absorciÃģn intestinal, es un proceso que requiere mantener una constante fuente de combustile.
ÂŋQuÃĐ componentes especÃficos de la microbiota median este efecto? Los autores mostraron que el frÃo provoca un profundo aumento en la proporciÃģn de Firmicutes a Bacteroidetes, asà como una pÃĐrdida casi completa de especies Verrucomicrobia, incluyendo Akkermansia muciniphila. Estos cambios se han evidenciado previamente en modelos de obesidad en ratones y estÃĄn relacionados con un aumento de la extracciÃģn energÃĐtica de las comidas. Cuando A. muciniphila se aÃąade a la microbiota adaptada al frÃo, el efecto en el aumento de la absorciÃģn intestinal es inhibido. Sin embargo, el pardeamiento y la sensibilidad a insulina no se ven alterados por la reposiciÃģn de esta especie. Trabajos previos tambiÃĐn han demostrado que A. muciniphila promueve el adelgazamiento e incrementa el gasto energÃĐtico en ratones, induciendo un patrÃģn de expresiÃģn gÃĐnica en tejido adiposo sugerente de una mayor oxidaciÃģn de ÃĄcidos grasos  (como podrÃa ocurrir en el caso del pardeamiento). Por lo tanto, el preciso rol de akkermansia en el balance de energÃa es complejo, y la identidad especÃfica de bacterias pro-pardeamiento, activadas por frÃo, sigue sin aclararse.
Existen otros aspectos a considerar antes de aÃąadir la obesidad y la resistencia insulÃnica a la lista de enfermedades que pueden ser susceptibles a una terapia con probiÃģticos o trasplante fecal. Una publicaciÃģn de los mismos investigadores, sugiere que el tratamiento con antibiÃģticos, que elimina la microbiota intestinal, tambiÃĐn induce pardeamiento y pÃĐrdida de peso (Nat Med. 2015 Dec;21(12):1497-501). Este hallazgo puede recorrer un largo camino en explicar la observaciÃģn que los ratones libres de gÃĐrmenes son delgados y altamente resistentes a la obesidad inducida por la dieta. Sin embargo, no es un ejercicio sencillo integrar estos resultados con los que muestran que la microbiota adaptada al frÃo promueve el pardeamiento. AdemÃĄs, la terapia con antibiÃģticos estÃĄ asociada con el aumento de peso corporal en animales y en humanos, aunque es posible que el tratamiento utilizado por los investigadores no interfiera en el pro-pardeamiento promovido por especies bacterianas en los animales de prueba.Â
Alternativamente, el tiempo y duraciÃģn del tratamiento pueden ser de importancia fundamental en la determinaciÃģn del resultado final de la terapia con antibiÃģticos, en relaciÃģn con la adiposidad. TambiÃĐn se encuentra la consideraciÃģn acerca de si la potenciaciÃģn del pardeamiento en humanos es una estrategia terapÃĐutica viable. Los primeros esfuerzos en esta ÃĄrea han producido resultados mixtos que no han sido tan homogÃĐneos como los observados en roedores.Â
AÚn asÃ, este trabajo muestra que todavÃa queda mucho por aprender sobre el microbioma intestinal y sobre cÃģmo integrarlo a la forma en que se concibe el metabolismo del organismo. Por otra parte, se ha provisto de un ejemplo acerca de cÃģmo mÚltiples Ãģrganos y sistemas (en este caso, el tejido adiposo y el intestino) mantener una homeostasis general frente a un desafÃo ambiental. La accesibilidad del intestino lo hace atractivo para enfoques experimentales para combatir la obesidad y diabetes tipo 2. Sin embargo, futuros estudios deberÃĄn revelar la forma en que realmente pueden tratarse estas patologÃas.
Fuente bibliográfica
Burning Fat by Bugging the System
Evan D. Rosen, M.D., Ph.D.
Division of Endocrinology, Diabetes, and Metabolism, Beth Israel Deaconess Medical Center and Harvard Medical School â Boston.
DOI: 10.1056/NEJMcibr1515457