Un muro para la microbiota flagelada
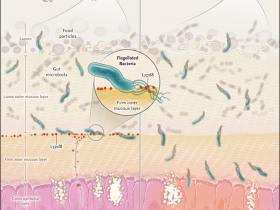
Las cĂ©lulas epiteliales del colon están cubiertas por capas de mucosa internas y externas que difieren en su espesor. La capa interior está libre de microorganismos comensales lo que contribuye al mantenimiento de la homeostasis del intestino. En este Ăłrgano, se han identificado molĂ©culas crĂticas para prevenir una invasiĂłn bacteriana. A pesar de la existencia de barreras fĂsicas contra un gran nĂşmero de bacterias presentes en estos sitios, los mecanismos que permiten esta divisiĂłn no están totalmente aclarados. Recientes estudios han mostrado que la proteĂna Lypd8 impide el paso de la microbiota flagelada hacia el epitelio del colon en ratones. Esta macromolĂ©cula es expresada selectivamente en las cĂ©lulas epiteliales de la capa superior de la glándula grande intestinal, secretándose hacia el lumen para unirse al flagelo que otorga movilidad, lo que se ha vinculado a una regulaciĂłn de la respuesta inflamatoria. Adicionalmente, en biopsias de colon de pacientes con patologĂas inflamatorias intestinales, se ha encontrado que los niveles de Lypd8 son escasos, lo que es consistente con un rol protector de esta proteĂna contra esta invalidante complicaciĂłn.
InhibiciĂłn de la motilidad bacteriana
La mantenciĂłn de la microbiota intestinal separada fĂsicamente de las cĂ©lulas epiteliales del hospedero es fundamental para la salud. Una brecha del epitelio puede inducir enfermedades agudas y permitir la infecciĂłn sistĂ©mica. Además, la invasiĂłn de bacterias en el epitelio promueve condiciones inflamatorias crĂłnicas, incluyendo enfermedad inflamatoria intestinal y sĂndrome metabĂłlico. A pesar de que bacterias mĂłviles parecen estar bien equipadas para superar la  barrera intestinal, Okumura y colegas (Nature. 2016 Apr 7;532(7597):117-21) han descubierto que las cĂ©lulas epiteliales del colon secretan una molĂ©cula, llamada Lypd8 que inhibe sus flagelos, por lo tanto, mantiene a estos microorganismos potencialmente problemáticos a una distancia segura.
Aproximadamente 100 trillones de bacterias constituyen la microbiota intestinal. En conjunto, ayudan a la digestiĂłn, metabolismo, y la inmunidad. La protecciĂłn del hospedero de la microbiota implica varios mecanismos. En primer lugar, una capa de mucosa proporciona una barrera fĂsica; en el colon, esta consiste en una capa interior firme y en una capa luminal más frágil. La gran mayorĂa de las bacterias del colon están en el lumen y en la capa de mucosa externa. Normalmente, la parte interna está libre de cĂ©lulas bacterianas. Sin embargo, esta barrera fĂsica por sĂ sola es insuficiente para restringir totalmente su acceso. El hospedero utiliza una gama de pĂ©ptidos antimicrobianos, tales como Reg III-gamma, una lectina tipo C que rompe las membranas de bacterias gram-positivas y que es fundamental para mantener la capa  de mucosa interna libre de microorganismos. Pero, dada la capacidad de las bacterias mĂłviles para impulsarse por varios micrĂłmetros por segundo, el organismo requiere de mecanismos de defensa adicionales.
El flagelo, que se compone de polĂmeros grandes de la proteĂna flagelina, otorga la motilidad a la cĂ©lula bacteriana. Una amplia diversidad de bacterias en el intestino son flagelados, y los que pertenecen a la clase Gammaproteobacteria, se vinculan a menudo con enfermedades inflamatorias. El peligro potencial que plantean los microorganismos mĂłviles es mejor apreciado teniendo en cuenta la amplia gama de mecanismos utilizados por el sistema inmunolĂłgico para mantenerlos a raya. El sistema inmune innato tiene dos medios para detectar y combatir las bacterias flageladas. La primera consiste en el receptor tipo toll 5 (TLR5), proteĂna que se expresa en la superficie de cĂ©lulas epiteliales y de fagocitos intestinales. Para la detecciĂłn de flagelina, TLR5 activa la producciĂłn de antimicrobianos peptĂdicos y estimula la secreciĂłn de quimiocinas que orquestan el reclutamiento de neutrĂłfilos. El segundo mecanismo implica la participaciĂłn del receptor tipo NOD, proteĂna intracelular. Su mecanismo de acciĂłn se basa en la activaciĂłn de un complejo llamado inflamasoma, lo que resulta en la muerte de cĂ©lulas infectadas y la liberaciĂłn de una potente citoquina. La flagelina es tambiĂ©n un objetivo importante de la inmunidad adaptativa. De hecho es un blanco predominante de cĂ©lulas T y de las cĂ©lulas encargadas de la respuesta humoral durante una infecciĂłn aguda y en la enfermedad inflamatoria crĂłnica. La inmunoglobulina A (IgA) especĂfica para flagelina es esencial para el mantenimiento de los niveles bajos de bacterias flageladas en el intestino. Por otro lado, ratones que han sido diseñados experimentalmente para no presentar alguno de estos mecanismos, son incapaces de limitar espacialmente a las abcterias flageladas y son propensos a desarrollar inflamaciĂłn. Por lo tanto, el reciente descubrimiento de que Lypd8 restringe el acceso de bacterias flageladas a la capa de mucosa interna del colon, es un notable avance en el entendimiento de la interacciĂłn hospedero-microbiota.
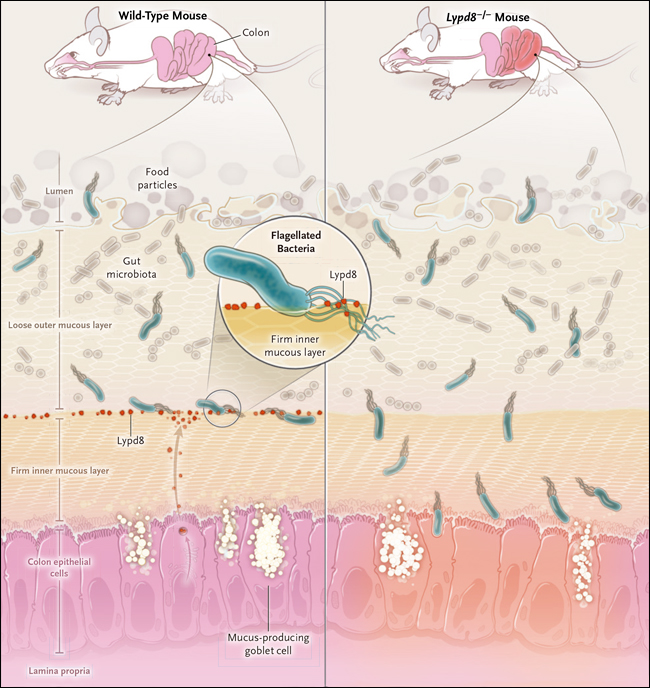
Figura 1. Lypd8 custodia a bacterias flageladas.
En ratones normales, la proteĂna Lypd8 se encuentra en el lĂmite entre las capas de mucosa exteriores e interiores. La microbiota intestinal está presente en el lumen y en la capa de mucosa externa. La proteĂna Lypd8 se une a los flagelos de bacterias mĂłviles e inhibe su movimiento. En ratones, que mediante ingenierĂa genĂ©tica se suprime la expresiĂłn de esta proteĂna, las bacterias flageladas son capaces de penetrar en la capa de mucosa interna.
Lypd8 es secretada por las cĂ©lulas epiteliales del colon y se localiza en la interfase entre las capas dĂ©biles y gruesas de la mucosa (figura 1). Se encarga de acorralar bacterias mĂłviles, al dirigirse a sus flagelos bloqueando su motilidad. En consecuencia, la capa mucosa firme de ratones que carecen Lypd8 es susceptible a la invasiĂłn por bacterias flageladas. En particular, se detectan proteobacterias de los gĂ©neros proteus, escherichia y helicobacter, todas implicadas en la inflamaciĂłn. Aunque su invasiĂłn no induce un fenotipo basal obvio, da lugar a ratones altamente propensos al desarrollo de colitis tras ser desafiados quĂmicamente. El hallazgo de que la expresiĂłn de Lypd8 es baja en muestras de biopsia de colon de pacientes con afecciones inflamatorias intestinales, es consistente con que esta proteĂna tiene un rol protector contra esta condiciĂłn, aunque se requieren de más estudios para determinar este beneficio.
El mecanismo de protecciĂłn de Lypd8 es Ăşnico, ya que esta proteĂna se produce sĂłlo en el colon y es expresada constitutivamente (constantemente), independientemente de si los animales sean portadores o sean capaces de sensar la microbiota intestinal. Por lo tanto las bacterias flageladas, pueden ser un elemento muy antiguo de la microbiota intestinal y puede ser que Lypd8 sea su enemiga desde tiempos remotos. El hecho de que el nivel de expresiĂłn de Lypd8 sea constante y no sea regulado dinámicamente apunta a una oportunidad terapĂ©utica: la sobrerregulaciĂłn de su expresiĂłn para mejorar enfermedades inflamatorias crĂłnicas promovidas por microbios intestinales flagelados.
Temas Relacionados