TransiciĂłn maligna en la hematopoiesis
Las leucemias agudas de varios tipos se encuentran entre los trastornos sanguĂneos más graves. La leucemia causa una severa enfermedad, con elevadas tasas de mortalidad. Una mejor comprensiĂłn de las causas de las distintas formas de esta patologĂa podrĂa llevar a un diagnĂłstico más temprano y un tratamiento más efectivo. Dentro de lo que se conoce, el gen ASXL1 a menudo se encuentra mutado en cánceres mieloides y tambiĂ©n en la hematopoyesis clonal de potencial indeterminado (CHIP, por sus siglas en inglĂ©s) un trastorno que se caracteriza por mutaciones somáticas en cĂ©lulas hematopoyĂ©ticas pero sin otros criterios para ser catalogado como cáncer hematolĂłgico. A su vez la CHIP se asocia con una mayor probabilidad de progresiĂłn a cánceres mieloides y linfoides. Por lo que su estudio enfocado en un diagnĂłstico temprano podrĂa conferir a futuro mejores resultados a los pacientes.
Mutaciones en Asxl1
Diversas mutaciones en ASXL1 están localizadas en el Ăşltimo exĂłn (codificando la regiĂłn C-terminal de la proteĂna ASXL1) y son "dominantes-negativas " - es decir, resultan en una proteĂna mutante que inhibe la proteĂna ASXL1 normal codificada por el alelo silvestre. Nagase y sus colegas describieron recientemente un modelo de ratĂłn de CHIP que diseñaron mediante el "knockout" condicional de una mutaciĂłn Asxl1 en el Ăşltimo exĂłn de Asxl1 (DOI: 10.1084/jem.20171151). La versiĂłn mutada de Asxl1 se expresĂł en la mayorĂa de las cĂ©lulas hematopoyĂ©ticas en el ratĂłn mutante, junto con Asxl1 de tipo silvestre; el ratĂłn tenĂa caracterĂsticas tĂpicamente vistas en la CHIP, con inclinaciĂłn mieloide, anemia dependiente de la edad, trombocitosis y displasia morfolĂłgica.
Los autores luego se preguntaron si la hematopoyesis clonal conduce a la leucemia. Los ratones tuvieron alteraciones en el epigenoma (las modificaciones bioquĂmicas del genoma o de las proteĂnas que componen la cromatina) con reducciones sustanciales en H3K4me3 (trimetilaciĂłn de la lisina 4 en la proteĂna histona 3) y H2AK119Ub (ubiquitinaciĂłn de la histona 2, que está relacionada con el silenciamiento del gen mediado por polycomb). La leucemia no se desarrollĂł en los ratones mutantes durante un perĂodo de observaciĂłn de 18 meses.
Sin embargo, la sobreexpresiĂłn de Runx mutado en la mĂ©dula Ăłsea de los ratones mutantes Asxl1 fue seguida por el desarrollo de leucemia mieloide aguda y hepatoesplenomegalia despuĂ©s de un corto perĂodo de latencia. (La sobreexpresiĂłn de RUNX mutado ha sido identificada en pacientes con el sĂndrome mielodisplásico y leucemia). De manera similar, la mutagĂ©nesis insercional mediada por retrovirus se utilizĂł para generar mutaciones adicionales en los ratones mutantes Asxl1. Se desarrollĂł leucemia aguda en todos los ratones infectados (figura 1).
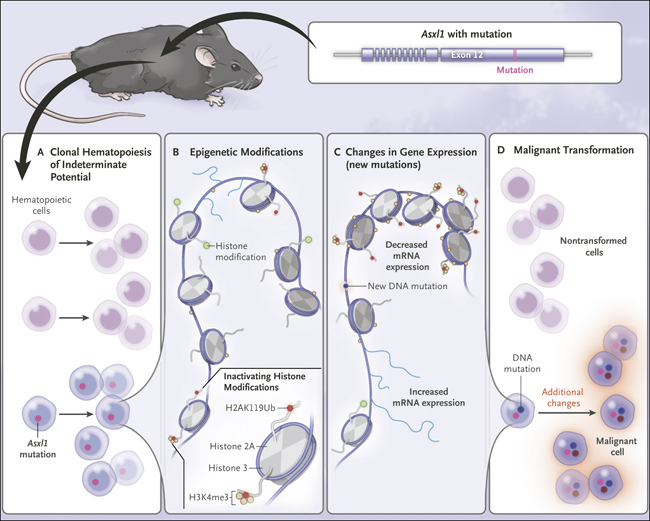
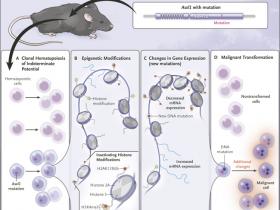
Figura 1. Modelando la transformaciĂłn de la hematopoyesis clĂłnica de potencial intermedio (CHIP) a la leucemia mieloide aguda.
Nagase y sus colegas describieron recientemente un modelo de ratón de CHIP y su transformación a un modelo de leucemia mieloide aguda. Una mutación en Asxl1 causa CHIP (panel A) y conduce a modificaciones epigenéticas con reducciones sustanciales en H3K4me3 y H2AK119Ub (panel B). Esto causa alteraciones en la expresión génica y puede conducir a nuevas mutaciones (panel C). Finalmente, las mutaciones y alteraciones adicionales en la expresión génica pueden conducir a una transformación maligna (panel D). El término ARNm denota ARN mensajero.
La hematopoyesis en el modelo de ratón de CHIP mostró varias anormalidades: un aumento en las células mieloides y células mieloides inmaduras y un modesto bloqueo en el desarrollo eritroide. En la médula ósea, se observó una reducción de las células madre hematopoyéticas a largo plazo y de las células progenitoras multipotentes. En un ensayo de trasplante competitivo, en el que se comparan células madre mutantes con células madre normales, las primeras mostraron una reducción del injerto en sangre periférica y médula ósea. Sin embargo, las células madre hematopoyéticas a largo plazo y las progenitoras multipotentes no se vieron afectadas, lo que lleva a la conclusión de que la supervivencia de las células madre hematopoyéticas no se ve afectada. Estos hallazgos pueden explicar en parte por qué se mantuvo el crecimiento clonal.
El diagnĂłstico de la hematopoyesis clonal implicarĂa idealmente la identificaciĂłn del clon en expansiĂłn de cĂ©lulas madre y progenitoras antes de la transformaciĂłn al sĂndrome mielodisplásico y a la leucemia mielodisplásica aguda, de modo que se pudieran probar intervenciones para prevenir la transformaciĂłn. Desafortunadamente, esto no es posible, debido a la falta de marcadores especĂficos en la superficie celular para identificar el clon en expansiĂłn. En consecuencia, los mĂ©dicos actualmente se limitan a los factores hematolĂłgicos (alteraciĂłn mieloide, anemia y trombocitosis) junto con la secuenciaciĂłn de los genes candidatos (por ejemplo, TET2, DNMT3A y ASXL1) en las cĂ©lulas hematopoyĂ©ticas.
De manera similar, una vez que el cáncer se ha desarrollado, un diagnĂłstico temprano se asocia con mejores resultados. No obstante, actualmente no es posible tratar el sĂndrome mielodisplásico y la leucemia mielodisplásica aguda a nivel de "precisiĂłn" porque se carece de fármacos que bloqueen especĂficamente la funciĂłn de la proteĂna mutante (por ejemplo, ASXL1) en humanos.
Sin embargo, el cribaje (screening) es tĂ©cnicamente posible, y si se diagnostica CHIP, los sĂntomas pueden ser tratados al menos parcialmente, y el paciente puede ser monitoreado para el desarrollo de cáncer. Pero debido a que la CHIP se encuentra en por lo menos el 10% de las personas de 70 a 80 años de edad, tal revisiĂłn serĂa un desafĂo. Aunque estas personas tienen un riesgo más alto de neoplasia hematolĂłgica (por un factor de aproximadamente 13) en comparaciĂłn con la poblaciĂłn en general, la frecuencia de transformaciĂłn es de sĂłlo 0,5 a 1% por año, lo que hace difĂcil justificar la evaluaciĂłn con las herramientas actualmente disponibles.
Fuente bibliográfica
Tipping Clonal Hematopoiesis into Transformation
Stefan Karlsson, M.D., Ph.D.
Department of Molecular Medicine and Gene Therapy, Lund University, Lund, Sweden.
DOI: 10.1056/NEJMcibr1803641