Reseteo celular para frenar el envejecimiento
El envejecimiento es el principal factor de riesgo para muchas enfermedades humanas. Estudios in vitro han demostrado que la reprogramación celular a estadíos de pluripotencia invierte la edad celular, pero la alteración del proceso de envejecimiento no se ha demostrado directamente bajo condiciones in vivo. Recientes investigaciones reportan que la reprogramación parcial por expresión cíclica de corto plazo de 4 factores de transcripción (Oct4, Sox2, Klf4 y c-Myc) mejora las características celulares y fisiológicas del envejecimiento y prolonga la vida en un modelo de ratón de envejecimiento prematuro. De forma similar, la expresión de OSKM in vivo optimiza la recuperación de la enfermedad metabólica y la lesión muscular en ratones silvestres de edad avanzada. La mejora de los fenotipos asociados a la edad por remodelación epigenética durante la reprogramación celular destaca el papel de la desregulación epigenética como un conductor clave del envejecimiento en mamíferos. Futuras investigaciones oriantadas a establecer plataformas in vivo para modular las marcas epigenéticas asociadas a la edad pueden proporcionar información valiosa acerca de la biología del envejecimiento.
Reprogramación parcial
En 2006, Takahashi y Yamanaka (Cell. 2006 Aug 25;126(4):663-76) dieron a conocer el asombroso efecto de forzar simultáneamente la expresión de un "cóctel" de cuatro factores de transcripción (OCT4, SOX2, KLF4 y cMYC) en células de cultivo. Este cóctel secuestró los controles y reguladores que determinan qué puede o no puede realizar una célula y "revirtieron" las células hacia un estado muy similar al de las células madre embrionarias, que poseen características muy especiales: existen solo brevemente durante las primeras etapas del desarrollo. Además, son pluripotentes y eventualmente dan origen a todas las células que constituyen al organismo adulto. La generación de células pluripotentes en laboratorio fue una hazaña impresionante. Estas células fueron denominadas células madre pluripotentes inducidas (iPSCs, por sus siglas en inglés). Ahora sabemos que las células de todas las fuentes de un organismo adulto, cuando se exponen a este cóctel de factores, pierden sus características distintivas y sufren una transición hacia una fase indiferenciada inestable, y eventualmente se convierten en iPSCs estables.
Los científicos optimizaron las condiciones de cultivo in vitro para guiar la diferenciación de las iPSC en tipos de células clínicamente relevantes que se pueden utilizar con fines terapéuticos. Por ejemplo, las células de la piel de un paciente que ha tenido un infarto de miocardio se puede convertir en iPSC en el laboratorio y luego diferenciarse en cardiomiocitos. La esperanza es que estos cardiomiocitos sanos puedan ser trasplantados en la cicatriz de infarto para restaurar, al menos parcialmente el tejido y la función cardíaca. Resultados de estudios en animales sugieren que este enfoque es factible (doi: 10.1038/nrm.2016.10). Otro ejemplo más reciente es el descrito por Michiko Mandai y colegas (doi: 10.1056/NEJMoa1608368) en el que se muestra el trasplante de células epiteliales del pigmento retiniano (obtenido desde las iPSCs) dentro la mácula de una mujer con degeneración macular avanzada relacionada con la edad.
Los investigadores también están explorando la posibilidad de establecer un procedimiento similar, pero directamente en el tejido u órgano dañado, es decir, una reprogramación in situ seguida de una diferenciación. Esto evitaría la manipulación de las células en el laboratorio y no requeriría el trasplante de células, proceso que por lo general es ineficiente. La expresión de los cuatro factores de transcripción en ratones (Nature 2013; 502: 340-5; Cell 2014; 156: 663-77) demostró tener efectos transformadores similares a los observados in vitro: una fracción de células dentro de los tejidos pierden sus rasgos distintivos, se vuelven indiferenciados y eventualmente se convierten en iPSCs.
La generación de iPSCs in vivo es importante desde un punto académico pero no es deseable para aplicaciones clínicas, porque se sabe que las iPSCs producen un tipo de tumor conocido como teratoma. De hecho, los ratones que expresan los cuatro factores de transcripción por un período suficientemente largo (≥ 1 semana) eventualmente desarrollan múltiples teratomas. Una perspectiva aún más interesante que lograr una reprogramación completa in vivo, es la inducción de reprogramación parcial (es decir, la inducción de células indiferenciadas que no son todavía iPSCs). Tras la expresión transitoria del cóctel la mayoría de las células reprogramadas generadas dentro de los tejidos son capaces de re diferenciarse en células sanas con la capacidad de lograr la restauración completa de la arquitectura tisular, lo cual indica que las células parcialmente reprogramadas in vivo son funcionales.
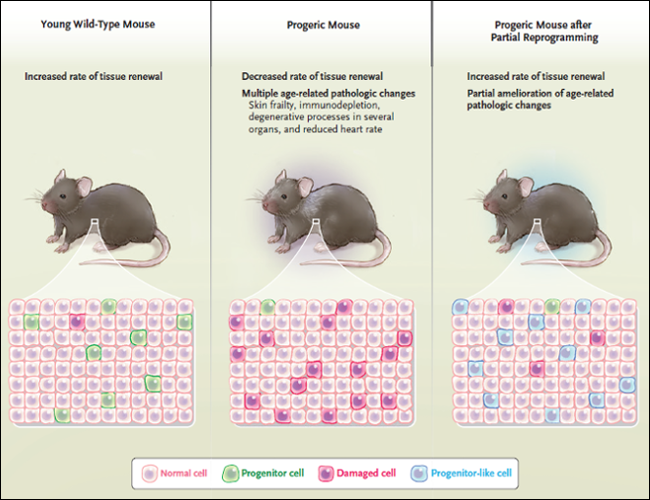
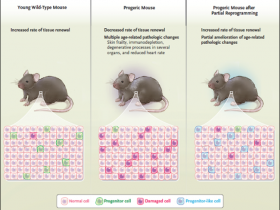
Figura 1: Reprogramar las células para frenar el envejecimiento
Los tejidos de animales jóvenes se caracterizan por tener una elevada tasa de renovación celular, que está respaldada por un número relativamente alto de células progenitoras activas y pocas células dañadas. Por el contrario, los tejidos de animales más viejos tienen bajas tasas de renovación celular - en parte debido a un bajo número de progenitores activos - y por lo tanto acumulan células dañadas. La reprogramación parcial, generada por un pulso de expresión de cuatro factores de transcripción (OCT4, SOX2, KLF4, y cMYC), tal como fue realizado por Alejandro Ocampo y colaboradores (Cell. 2016 Dec 15;167(7):1719-1733) impulsa a algunas células hacia un estado indiferenciado con propiedades de progenitoras. Estas células progenitoras renuevan el tejido y favorecen la sustitución de células dañadas, lo que da como resultado un rejuvenecimiento tisular.
Alejandro Ocampo y colegas (Cell. 2016 Dec 15;167(7):1719-1733) recientemente mostraron que la reprogramación parcial in vivo "rejuvenece" tejidos viejos y extiende la vida de ratones progéricos (figura 1). Los autores plantearon que pulsos cortos de expresión de los cuatro factores de transcripción podían reprogramar parcialmente algunas células, las que adquirían un estado semejante a un progenitor sin ser totalmente reprogramadas en iPSC. En efecto, cuando los ratones fueron sometidos a este protocolo durante un período de 3 semanas, los investigadores no pudieron encontrar marcadores de reprogramación completa ni teratomas. Ratones viejos que fueron sometidos a tres ciclos de reprogramación parcial se volvieron más resistentes a una lesión tisular subsiguiente, como la lesión que típicamente ocurre en respuesta a cardiotoxina (que puede dañar miocitos) o estreptozotocina (que es tóxica para las células beta de los islotes de Langerhans).
Los investigadores también expresaron los cuatro factores de transcripción en un modelo de ratón para el estudio del síndrome de progeria de Hutchinson-Gilford. Estos roedores envejecen de forma prematura y típicamente mueren a los 4,5 meses (el tiempo de vida normal de estos animales es de aproximadamente 2,5 años). Notablemente, impulsos cíclicos de reprogramación parcial amplió la esperanza de vida de los ratones progéricos en un 33%, a 6 meses. Con esta forma de progeri, se desarrollan últiples condiciones patológicas relacionadas con el envejecimiento, incluyendo fragilidad de la piel, inmunodepleción, procesos degenerativos en el intestino, riñón, y vasos sanguíneos; y frecuencia cardíaca reducida. Impresionantemente, todos estos defectos fueron aminorados parcialmente mediante la reprogramación parcial cíclica.
Aunque hay muchas preguntas que aún siguen sin ser respondidas, incluyendo interrogantes sobre los efectos a largo plazo de la reprogramación parcial en modelos de animales de larga vida, el trabajo de Ocampo y sus colegas sugiere un enfoque general para la regeneración de tejidos in situ. Una mejor comprensión de la reprogramación celular in vivo permitirá un mejor diseño de terapias de reparación tisulares.
Fuente bibliográfica
Understanding Aging
Manuel Serrano, Ph.D.
Spanish National Cancer Research Center (CNIO), Madrid.
DOI: 10.1056/NEJMcibr1615878
Temas Relacionados