RegulaciĂłn epigenĂŠtica del asma
La interleuquina 9 (IL-9) es una citoquina pleiotrĂłpica asociada con la inflamaciĂłn alĂŠrgica y es una diana terapĂŠutica en pacientes con asma. Su expresiĂłn y la de su receptor son mayores en los pulmones de las personas con asma que en los de las personas sanas. En los modelos murinos de enfermedad alĂŠrgica de las vĂas respiratorias, la IL-9 promueve la hiperreactividad de las vĂas respiratorias, la remodelaciĂłn y la inflamaciĂłn, con una caracterĂstica clave que es el reclutamiento y activaciĂłn de mastocitos. Se piensa que un subconjunto de cĂŠlulas T CD4, denominadas cĂŠlulas Th9, es la fuente dominante de IL-9 en asmĂĄticos, y su nĂşmero aumenta en alĂŠrgicos. Las Th9 son suficientes para promover la enfermedad alĂŠrgica de las vĂas respiratorias en modelos de ratones, y el bloqueo de su diferenciaciĂłn reduce la gravedad patolĂłgica en estos modelos, lo cual representa un punto clave para evaluar nuevas alternativas terapĂŠuticas en humanos.
CĂŠlulas productoras de IL-9
En un reciente estudio, Xiao y sus colegas demostraron la importancia del escenario epigenĂŠtico que rodea a Il9 (el gen que codifica la IL-9 en ratĂłn) sobre la regulaciĂłn de la diferenciaciĂłn de las cĂŠlulas Th9 (DOI: 10.1084/jem.20170928). EspecĂficamente, encontraron que elementos super potenciadores (super enhancer) rĂo abajo de Il9 son fundamentales para impulsar la producciĂłn robusta de IL-9 por parte de las cĂŠlulas T CD4 y promover la enfermedad alĂŠrgica de las vĂas respiratorias. Los super enhancer son ĂĄreas del genoma que (mediante cambios secundarios y terciarios en la estructura de la cromatina) entran en contacto con promotores de genes y son ĂĄreas a las que se unen complejos transcripcionales. Al facilitar la yuxtaposiciĂłn de complejos transcripcionales con un promotor de genes, pueden mejorar la expresiĂłn de ese gen.
A menudo se identifican, como en el estudio de Xiao y sus colegas, por la agrupaciĂłn de una proteĂna histĂłnica especĂfica (H3) que es acetilada en la lisina 27 (H3K27Ac), una marca de actividad transcripcional. (Las histonas forman estructuras en forma de carrete alrededor de las cuales se enrolla el ADN y tambiĂŠn regulan la estructura de la cromatina y la expresiĂłn gĂŠnica. Histonas acetiladas pueden estar unidas a una familia de proteĂnas denominada bromodominio y dominio extraterminal (familia BET) que modifican la expresiĂłn gĂŠnica.
La producciĂłn de IL-9 por parte de las cĂŠlulas T CD4 es impulsada por su exposiciĂłn a combinaciones especĂficas de citoquinas. Los investigadores encontraron que la estimulaciĂłn de una vĂa de seĂąalizaciĂłn diferente de las cĂŠlulas T CD4 (que involucra al receptor OX40) in vitro, aumenta este proceso al incrementar drĂĄsticamente el nĂşmero de cĂŠlulas T CD4 productoras de IL-9 a travĂŠs de una serie de eventos que resultan en la acetilaciĂłn de histonas (especĂficamente, H3K27) tanto en Il9 como en una regiĂłn superenhancer rĂo abajo del sitio de inicio de la transcripciĂłn de Il9.
Esto a su vez resultĂł en el reclutamiento de BRD4, una proteĂna BET, y la formaciĂłn de un bucle de cromatina entre el superenhancer de Il9 y su promotor (Figura 1), un proceso que es esencial para la mĂĄxima diferenciaciĂłn de las cĂŠlulas Th9. Resaltando el potencial terapĂŠutico de esta nueva capa de regulaciĂłn de las cĂŠlulas Th9, los autores tambiĂŠn encontraron que el uso de un inhibidor BET, o el silenciamiento especĂfico de Brd4 en un modelo de ratĂłn de enfermedad alĂŠrgica de las vĂas respiratorias, resultĂł en una reducciĂłn de los niveles de IL-9, una disminuciĂłn de la inflamaciĂłn pulmonar y una reducciĂłn de la eosinofilia de las vĂas respiratorias.
Sin embargo, se debe tener precauciĂłn al interpretar este estudio como apoyo del potencial terapĂŠutico de dirigirse especĂficamente a la IL-9 en pacientes con asma. Xiao y colaboradores utilizaron el inhibidor BET (llamado JQ1) profilĂĄcticamente -antes de la apariciĂłn de la inflamaciĂłn pulmonar- en el modelo de ratĂłn, lo que no es factible en humanos. AdemĂĄs, un ensayo clĂnico que evaluĂł el bloqueo de OX40L que incluyĂł a personas con asma leve mostrĂł que la focalizaciĂłn en esta vĂa no tuvo efecto sobre el volumen espiratorio forzado inicial en 1 segundo (VEF1), ni sobre la respuesta alĂŠrgica en fase temprana o tardĂa, o el nĂşmero de exacerbaciones, aunque sĂ redujo la eosinofilia en esputo y el nivel total de IgE. AdemĂĄs, el uso de un anticuerpo monoclonal anti IL-9 en pacientes con asma moderada a severa no alterĂł el VEF1, las tasas de exacerbaciĂłn o la eosinofilia sanguĂnea. Por lo tanto, las estrategias diseĂąadas para afinar la producciĂłn de citocinas, por medio de marcas epigenĂŠticas, pueden ofrecer una nueva opciĂłn terapĂŠutica.
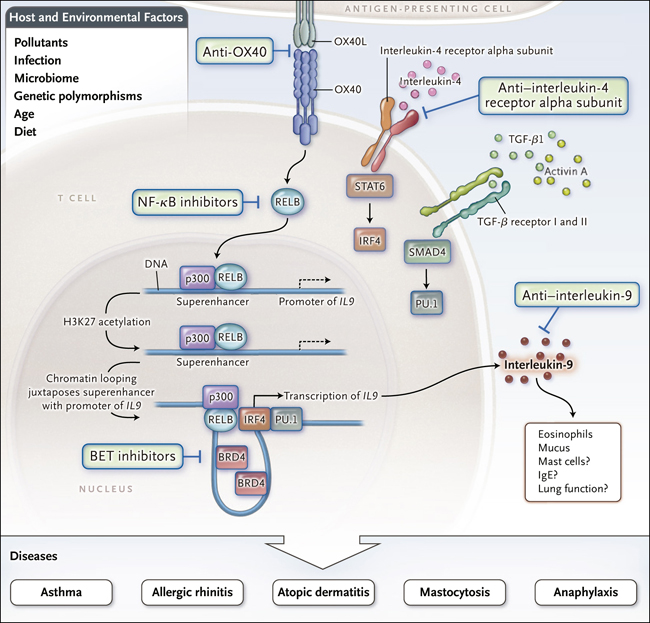
Figura 1. Control en la inflamaciĂłn alĂŠrgica y cĂŠlulas T secretoras de interleucina 9.
Xiao y colegas descubrieron recientemente que la producciĂłn de IL-9 por cĂŠlulas Th9 es potenciada por OX40, que activa RELB en conjunto con la histona acetiltransferasa p300, resultando en acetilaciĂłn de la proteĂna histona en la lisina 27 (H3K27) y en el reclutamiento de la proteĂna bromodominio y extraterminal (BET) BRD4. Se forma un bucle de cromatina entre el promotor de la IL9 y la regiĂłn superenhancer, maximizando asĂ la diferenciaciĂłn de las cĂŠlulas Th9 y facilitando potencialmente enfermedades en las que la IL-9 desempeĂąa un rol patogĂŠnico. La interrupciĂłn selectiva de este proceso, por ejemplo, con inhibidores BET puede representar una nueva estrategia terapĂŠutica para las enfermedades mediadas por la IL-9. Las cĂŠlulas Th9 secretoras de IL-9 (un subconjunto de cĂŠlulas T CD4) se desarrollan en respuesta a la activaciĂłn del transductor de seĂąal y activador de la transcripciĂłn 6 (STAT6) que es dependiente de IL-4. Este proceso impulsa la translocaciĂłn nuclear de un factor transcripcional denominado factor de regulaciĂłn del interferĂłn 4 (IRF4), combinado con la activaciĂłn dependiente del factor de crecimiento transformante β (TGF-β) de SMAD4, que promueve el factor de transcripciĂłn PU.1 (codificado por SPI1). IRF4 y PU.1 se unen al promotor de IL9. MĂşltiples elementos ambientales y del huĂŠsped influyen en la regulaciĂłn epigenĂŠtica de la producciĂłn de citoquinas durante la inflamaciĂłn alĂŠrgica. Estos factores afectan a los superenhancer que facilitan la expresiĂłn robusta de citoquinas.
La regulaciĂłn epigenĂŠtica de la producciĂłn de citoquinas por parte de las proteĂnas BET en el asma probablemente tiene efectos que son independientes de la diferenciaciĂłn de las cĂŠlulas Th9 o de la producciĂłn de IL-9. Las proteĂnas BET estĂĄn muy implicadas en la producciĂłn de interleuquinas proinflamatorias por parte de los macrĂłfagos, y se ha demostrado que los inhibidores BET limitan la inflamaciĂłn y mortalidad en modelos de sepsis y perturban la diferenciaciĂłn de cĂŠlulas T CD4 secretoras de IL-17, que tambiĂŠn se cree que participan en la patogĂŠnesis en algunos pacientes con asma. Por lo tanto, dirigir la actividad de la proteĂna BET a personas con asma que tienen inflamaciĂłn severa o heterogĂŠnea puede ser mĂĄs efectivo que los tratamientos existentes, que estĂĄn diseĂąados para abordar un aspecto de la patologĂa del asma (por ejemplo, IgE).
TambiĂŠn cabe destacar que aunque el presente estudio destaca el papel potencial de la regulaciĂłn epigenĂŠtica de la IL-9 en pacientes con asma alĂŠrgica, esta citoquina se ha implicado en otras enfermedades en las que se produce la acumulaciĂłn o activaciĂłn de mastocitos (Figura 1). Los autores no evaluaron el nĂşmero de este tipo celular ni su funciĂłn. Tampoco analizaron los niveles de IgE, y los modelos de asma alĂŠrgica en ratones no generan el nĂşmero sustancial de mastocitos ni la actividad que a menudo se presentan en pacientes con alergia. Por ende, se requiere trabajo adicional para determinar si la inhibiciĂłn de la BET por la JQ1 serĂa efectiva en las enfermedades dependientes de mastocitos, como la rinitis alĂŠrgica o la dermatitis atĂłpica.
En resumen, Xiao y sus colegas describen una nueva forma de regulaciĂłn epigenĂŠtica para la producciĂłn de citoquinas asociadas con el asma y, por lo tanto, proporcionan otro punto para tratar la inmunidad desrregulada en pacientes asmĂĄticos o alĂŠrgicos. Debido a que el tejido pulmonar asmĂĄtico se asocia con una mayor expresiĂłn de histonas acetilasas y una menor expresiĂłn de histonas deacetilasas, es tentador especular que las cĂŠlulas T CD4 en pacientes con asma podrĂan mostrar un aumento de la actividad superenhancer en el locus de la IL9 y otros loci - como consecuencia de influencias ambientales o genĂŠticas o una combinaciĂłn de ambas - y que dicha actividad pudiera explicar potencialmente la predisposiciĂłn para el desarrollo de la enfermedad atĂłpica en algunas personas, pero no en todas.
Fuente bibliográfica
Epigenetic Control of Interleukin-9 in Asthma
Clare M. Lloyd, Ph.D., and James A. Harker, Ph.D.
Section of Inflammation, Repair, and Development, National Heart and Lung Institute, Imperial College London.
DOI: 10.1056/NEJMcibr1803610