Rediseñando el riñón
Recientes investigaciones han reportado la generaciĂłn de cĂ©lulas madre pluripotentes inducidas humanas, derivadas de tejidos maduros como la piel. Tal acontecimiento, se logrĂł mediante la introducciĂłn y posterior expresiĂłn de genes exĂłgenos, que desencadenan un proceso conocido como reprogramaciĂłn. La gran relevancia de esta metodologĂa, es que permite obtener, a partir de tejidos ya diferenciados, cĂ©lulas capaces de convertirse en cualquier tipo celular del organismo, dependiendo del conjunto de factores de crecimiento administrados. Estos avances han posibilitado además la generaciĂłn de cĂ©lulas progenitoras del riñón, dando paso a diferentes cĂ©lulas madre de este Ăłrgano, las que finalmente son capaces de producir un organoide tipo riñón, con nefronas y otros tipos celulares necesarios para la funciĂłn renal. Estos hallazgos poseen un gran potencial terapĂ©utico, e incluyen el uso de estos organoides para ensayos de nefrotoxicidad frente a medicamentos, y a largo plazo, la posibilidad de utilizar este procedimiento para trasplantes de Ăłrganos, en casos complejos de insuficiencia renal.
Organoide renal
La enfermedad renal crĂłnica afecta a 1 de cada 9 estadounidenses y a más de 300 millones de personas en todo el mundo. De Ă©stos, aproximadamente el 2,5% tiene una etapa terminal de insuficiencia renal y requieren tratamiento con diálisis o de trasplantes para sobrevivir. El trasplante de riñón es la forma preferida de terapia de reemplazo; el 85% de los receptores sobreviven más de 5 años, en comparaciĂłn con aproximadamente un 40% de los que se somenten a diálisis. Sin embargo, hay una escasez crĂtica de donantes de Ăłrganos y además los tiempos de espera pueden ser superiores a 5 años en muchos centros de Estados Unidos. Además, los receptores del trasplante deben tomar potentes agentes inmunosupresores para prevenir el rechazo. Los avances en la biologĂa de cĂ©lulas madre y en medicina regenerativa, alienta la esperanza de que algĂşn dĂa, la ingenierĂa tisular de Ăłrganos, con baja inmunogenicidad, pueda resolver el problema de la escasez de Ăłrganos. Pese a que se han producido rápidos avances en la regeneraciĂłn de ciertos tejidos y de diversos tipos celulares (por ejemplo, de islotes del páncreas y de la tráquea), el riñón presenta algunos desafĂos especĂficos.
El riñón maduro es un Ăłrgano exquisitamente complejo que contiene más de 20 tipos especializados de cĂ©lulas. Además de estar compuesto de mĂşltiples cĂ©lulas diferenciadas, cada riñón contiene aproximadamente 1 millĂłn de unidades de filtraciĂłn conocidas como nefronas, que reciben cerca de un 20% del gasto cardĂaco y producen 180 litros de filtrado urinario primario cada dĂa. El proceso de filtrado asegura la excreciĂłn del exceso de sales y fluidos, de productos de desecho metabĂłlicos y de toxinas exĂłgenas. Además, el riñón y sus cĂ©lulas especializadas orquestan muchos otras funciones fisiolĂłgicas crĂticas, incluyendo la regulaciĂłn de la presiĂłn arterial, el pH, asĂ como tambiĂ©n la producciĂłn de glĂłbulos rojos y hormonas necesarias para la salud Ăłsea.
Los experimentos embriolĂłgicos clásicos, realizados por Grobstein en la dĂ©cada de 1950, identificaron dos tipos de cĂ©lulas progenitoras: del mesĂ©nquima metanĂ©frico (MM) y de la yema ureteral epitelial (UB, del inglĂ©s ureteric bud). Estas cĂ©lulas son necesarias y suficientes para formar todos los tipos celulares subsecuentes, las nefronas maduras y las del sistema recolector renal. Estas dos poblaciones de cĂ©lulas fundadoras, se derivan del mesodermo intermedio del feto. Un avance importante en la regeneraciĂłn tisular ha sido proporcionada por la identificaciĂłn de - cuatro genes: OCT4 (tambiĂ©n llamado POU5F1), KLF4, MYC (o CMYC), y SOX2 - los que codifican los denominados factores de Yamanaka, capaces de establecer una reprogramaciĂłn somática, de cĂ©lulas ya diferenciadas hacia un estado inducido de cĂ©lulas madre pluripotentes (iPSC, del inglĂ©s induced pluripotent stem cells). Dichas cĂ©lulas pueden proliferar y dar lugar a cualquier tipo de cĂ©lula en el cuerpo. Posteriormente, los investigadores determinaron el cĂłctel de genes y factores de crecimiento necesarios para provocar la diferenciaciĂłn de las iPSC en cĂ©lulas del MM o de la UB. Utilizando el conocimiento de estos hallazgos, se podrĂan crecer componentes del riñón maduro en laboratorio, sin embargo existe un gran obstáculo: cĂłmo persuadir a estos dos tipos de cĂ©lulas para diferenciarse, para producir un  riñón funcional, de una de manera coordinada.
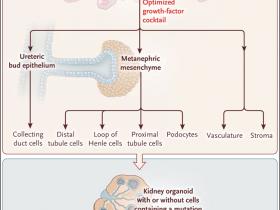
Al alterar el tiempo de exposición, dosis, y la presencia de factores de crecimiento, el estudio de Minoru Takasato y colegas (doi:10.1038/nature15695) reportó recientemente un método en cultivos tridimensionales, los que contienen hasta 500 nefronas individuales, en el que se gatilló la formación de nefronas a partir de iPSC humanas, a través de la generación de estructuras tipo riñón, denominadas organoides (figura 1). Utilizando marcadores moleculares, se confirmó la presencia de poblaciones incipientes de UB y MM,  mostrando que estos progenitores son capaces de diferenciarse en tipos celulares especializados de la nefrona, incluyendo podocitos, células del túbulo proximal y nefronas distales. El mismo cóctel de factores de crecimiento, promovió el desarrollo de células del endotelio vascular, algunas de los cuales se convirtieron en glomérulos, esenciales para la filtración. Adicionalmente se observaron células del estroma, localizadas entre las nefronas.
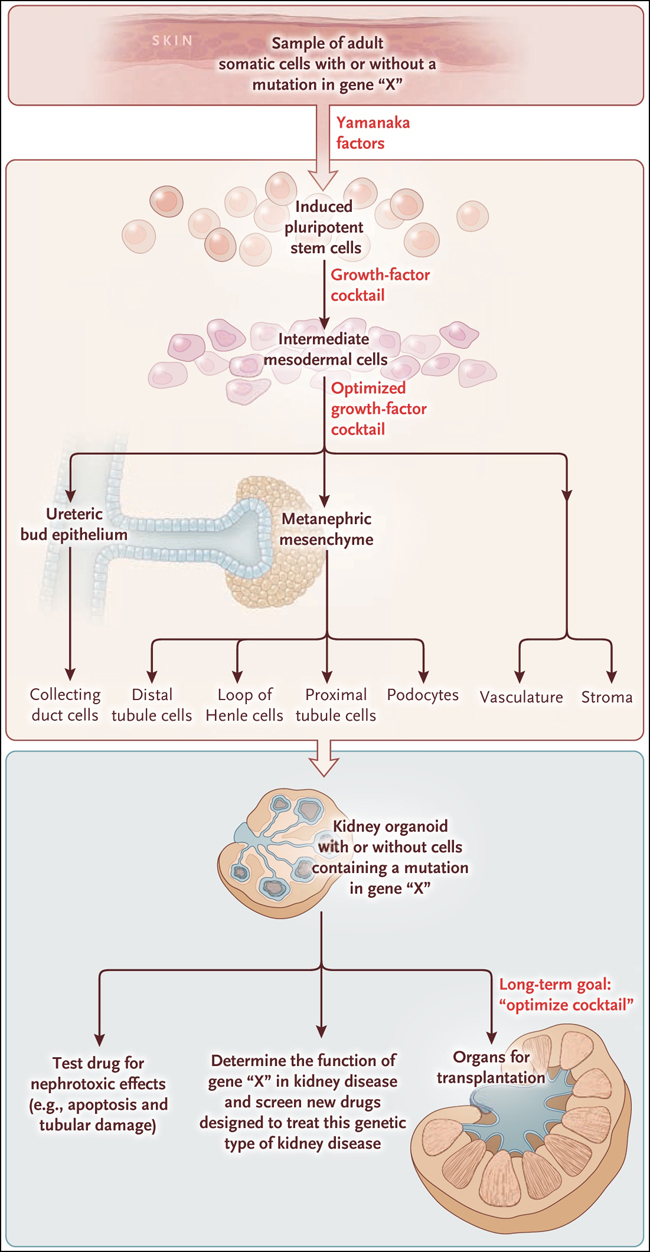
Figura 1. CreaciĂłn de un organoide renal.
Las cĂ©lulas madre pluripotentes inducidas (iPSC) se derivan de tejidos maduros (por ejemplo, la piel) mediante la introducciĂłn de cuatro genes que codifican los llamados factores de Yamanaka (OCT4 [conocido como POU5F1], KLF4, MYC [tambiĂ©n llamado MYC], y SOX2). Si el donante de cĂ©lulas de la piel lleva una mutaciĂłn en un gen, todas y cada una de las iPSC contendrán la misma mutaciĂłn. Tales cĂ©lulas tienen el potencial de convertirse en cualquier tipo celular del cuerpo, lo que es determinado por el cĂłctel especĂfico de factores de crecimiento que se proveen. Takasato y sus colegas identificaron la combinaciĂłn de factores necesarios para impulsar a las iPSC a convertirse en progenitores renales (mesodermo intermedio) lo que a su vez puede dar lugar a muchos tipos diferentes de cĂ©lulas maduras de riñón. Este proceso, en Ăşltima instancia, genera una organoide tipo riñón que contiene 500 nefronas o unidades filtradoras. Ciertas aplicaciones clĂnicas inmediatas pueden incluir pruebas de la nefrotoxicidad de medicamentos actuales o nuevas, tratando al organoide con el compuesto y determinando posibles lesiones renales. Adicionalmente, el organoide llevará la misma mutaciĂłn genĂ©tica en cĂ©lulas obtenidas de la donante original, permitiendo a los investigadores estudiar la funciĂłn de tales genes y probar nuevos fármacos para el tratamiento de la enfermedad resultante de la mutaciĂłn, en una estructura fisiolĂłgicamente relevante. El objetivo a largo plazo será optimizar el cĂłctel de factores de crecimiento para crecer tejidos renales más grandes y complejos, los que serĂan adecuados para el trasplante de Ăłrganos.
El potencial clĂnico de este descubrimiento es evidente. La capacidad de producir estructuras renales con poblaciones celulares representativas de tres compartimentos (nefronas, conducto colector, y del estroma), junto con vasos sanguĂneos, acerca el objetivo de alcanzar la meta de una generaciĂłn de riñones mediante ingenierĂa tisular para el trasplante. El desarrollo de riñones a partir de iPSC obtenidas de pacientes, podrĂa proporcionar una fuente de Ăłrganos autĂłlogos compatibles con el propio sistema inmune del afectado. Aunque se requieren de pasos adicionales para producir riñones con capacidad de filtraciĂłn completamente funcional y de sistemas vasculares capaces de manejar las demandas de los riñones endĂłgenos, este estudio representa un paso importante para alcanzar ese objetivo.
Una aplicaciĂłn inmediata es el uso organoides de riñón para la detecciĂłn de efectos nefrotĂłxicos de medicamentos nuevos o ya disponibles, evitando la necesidad de los costosos estudios in vivo. En esta investigaciĂłn, se demostrĂł la viabilidad de esta aplicaciĂłn: se observaron lesiones tubulares y apoptosis en la exposiciĂłn del organoide al cisplatino, un agente nefrotĂłxico conocido. Otra gran oportunidad, es la posibilidad de desarrollar organoides a partir de cĂ©lulas de pacientes con enfermedades renales genĂ©ticas, que proporcionarĂan un modelo de tejido complejo (fisiolĂłgica y genĂ©ticamente idĂ©nticos a los individuos a partir de los cuales se derivan las iPSC) para la determinaciĂłn de patogenicidad y para la prueba de nuevas terapias.
Fuente bibliográfica
Kindling the Kidney
Susan E. Quaggin, M.D.
From the Division of Nephrology and Hypertension and Feinberg Cardiovascular Research nstitute, Feinberg School of Medicine, Northwestern University, Chicago.
DOI: 10.1056/NEJMcibr1514351