Neuroblastos: invasores en el cáncer prostático
Las fibras nerviosas autónomas en el microambiente tumoral regulan el inicio y diseminación del cáncer, pero actualmente se desconoce cómo emergen las células nerviosas en los tumores. Recientemente, se demostró que progenitores neurales que expresan la proteína doblecortina (DCX+) infiltran tumores de próstata, en donde suscitan la neurogénesis. En modelos preclínicos de cáncer de próstata, las oscilaciones de los progenitores neurales DCX+ en la zona subventricular -un área neurogénica del sistema nervioso central- se asocian con la disrupción de la barrera hematoencefálica, y con la salida de las células DCX+ a la circulación. Estas se infiltran y se radican en el tumor, pudiendo generar nuevas neuronas adrenérgicas. En humanos, la densidad de los progenitores neurales DCX+ está fuertemente vinculada con la agresividad y recurrencia del adenocarcinoma de próstata. Por lo tanto, estos resultados revelan una interferencia única entre el sistema nervioso central y los tumores de próstata, e identifican potenciales dianas neurales para el tratamiento del cáncer.
Neo-neurogénesis
Muchos estudios en la última década han demostrado que las interacciones entre las células tumorales y las nerviosas pueden influir en la progresión de varios tipos de cáncer. En los tumores de próstata, la presencia de neuronas recién formadas está asociada con la progresión de neoplasia maligna, con diseminación a otras partes del cuerpo. El microambiente de un tumor puede permitir el desarrollo de estas nuevas células nerviosas en un proceso llamado neoneurogénesis. Sin embargo, la forma en que estas células emergen en los tumores en primer lugar ha sido una pregunta clave sin respuesta. En una reciente publicación, Mauffrey y colaboradores (Nature. 2019 May;569(7758):672-678) reportan un estudio hecho en ratones que indica que un tipo de célula precursora llamada célula progenitora neural, de una región del cerebro en la que ocurre el proceso normal de neurogénesis, migra al sitio del cáncer de próstata. Estas células invaden el microambiente tumoral y dan lugar a nuevas neuronas.
Actualmente, se cree que los procesos por los que se desarrollan los embriones y los tumores sólidos comparten muchas características. En la mayoría de los organismos multicelulares, el sistema nervioso y la vasculatura juegan un papel en ambos procesos. En ratones, las neuronas surgen a lo largo de la vida, por neurogénesis a partir de células progenitoras neurales en dos regiones del cerebro adulto: la zona subventricular y el giro dentado. Aunque últimamente existe controversia sobre la extensión de la neurogénesis en humanos adultos, décadas de trabajo previo han indicado que hay generación de nuevas neuronas a lo largo del curso de la vida, pero solo en el giro dentado.
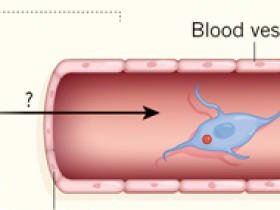
Para abordar el origen de las células nerviosas en los tumores de próstata, Mauffrey y sus colegas utilizaron un modelo de ratón llamado Hi-myc. Los autores informan que los tumores de próstata en estos animales se asocian con un tipo de neurona embrionaria llamada neuroblasto (figura 1). Estas células expresan la proteína doblecortin (DCX), que también se expresa en tipos especiales de células progenitoras neurales, que dan lugar a las neuronas.
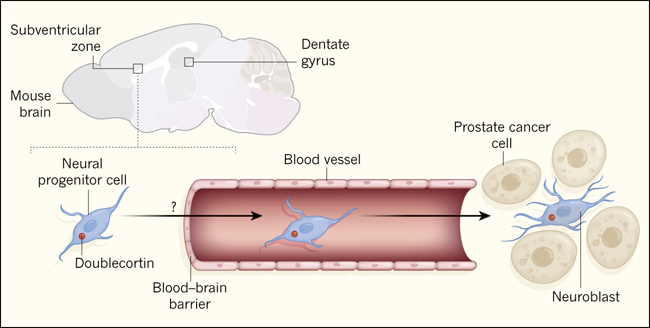
Figura 1. Las células nerviosas en los tumores de próstata surgen de las células cerebrales.
La formación de células nerviosas en el cerebro adulto del ratón se produce en la zona subventricular y en el giro dentado. Mauffrey y sus colegas (Nature. 2019 May;569(7758):672-678) reportaron que, en un modelo de ratón de cáncer de próstata, existe una brecha en la barrera hematoencefálica cerca de la zona subventricular que es causada por factores desconocidos. Las células progenitoras neuronales de la zona subventricular salen del cerebro a través de esta brecha, migran a través de los vasos sanguíneos e invaden específicamente los tumores de próstata. En el sitio del cáncer, las células progenitoras neurales, que expresan la proteína doblecortina (un marcador proteico que los autores utilizaron para seguir el desarrollo de las poblaciones de células neuronales), dan lugar a un tipo de célula nerviosa inmadura llamada neuroblasto, revelando los orígenes de las células nerviosas recién formadas en el microambiente tumoral que están relacionadas con la progresión del tumor.
Los autores aislaron células que expresan DCX (que podrían ser células progenitoras neurales o neuroblastos) de muestras de tumores de próstata de los animales, y analizaron la expresión de genes y proteínas. Usando un enfoque llamado perfil antigénico, rastrearon la fuente de las células neuroblásticas que expresan DCX y encontraron que las células expresaban varias proteínas características de las progenitoras neurales que pueden dar lugar a las neuronas. Los neuroblastos no expresaron el gen Myc, que impulsa la formación de tumores de próstata en el modelo Hi-myc, lo que llevó a los autores a concluir que estos neuroblastos probablemente no procedían de células tumorales. Otros perfiles de neuroblastos no revelaron ninguna similitud obvia con otros tipos celulares en el microambiente tumoral, como las células inmunitarias o endoteliales. Los autores encontraron que los neuroblastos asociados al tumor tenían sellos moleculares similares a los de células progenitoras neurales de la zona subventricular. Además, las células podrían diferenciarse en células tipo neuronas cuando se cultivan in vitro.
Mauffrey y sus colegas estudiaron a continuación las células progenitoras neurales en el cerebro de ratones, obteniendo un apoyo crucial para su propuesta de que estas impulsan la neo-neurogénesis en los tumores de próstata. Los autores rastrearon las células usando una técnica que marcan las células progenitoras neurales en regiones cerebrales específicas. Esto reveló que las progenitoras neurales de la zona subventricular pueden migrar desde el cerebro y viajar a través de los vasos sanguíneos para invadir específicamente los tumores de próstata. Sin embargo, se desconocen los factores moleculares y los mecanismos que guían la migración de estas células a este lugar. Los autores no encontraron evidencia de que las progenitoras neurales del giro dentado salieran del cerebro. Y reportan una brecha selectiva en la barrera hematoencefálica alrededor de la región de la zona subventricular, pero que dicha brecha no estaba asociada con el giro dentado.
Para determinar la relevancia de sus hallazgos para otros tipos de cáncer, Mauffrey y sus colegas utilizaron varios modelos de cáncer de ratón generados a través del trasplante de células tumorales humanas. Los autores observaron sistemáticamente un modo similar de migración de células neuroprogenitoras del cerebro a los tumores. Además, cuando utilizaron una técnica para diseñar ratones con agotamiento selectivo de células progenitoras neurales que expresan DCX y neuroblastos, los animales resultantes mostraron un establecimiento tumoral deficiente en comparación con los controles. Cuando los ratones portadores de tumores de próstata humanos fueron trasplantados con neuroblastos de tumores de próstata de ratón o con células progenitoras neurales de ratón de la zona subventricular, los animales de ambos grupos mostraron un mayor crecimiento tumoral y propagación del tumor a otras partes del cuerpo en comparación con los roedores que no recibieron trasplantes. Mauffrey y sus colegas también evidenciaron que una mayor densidad de neuroblastos observada en muestras de próstata de personas con cáncer de próstata se correlacionaba con una mayor agresividad y una recurrencia más rápida de los tumores de estos individuos.
Los hallazgos sugieren un papel previamente insospechado e intrigante de los neuroblastos derivados del cerebro para influir en el desarrollo y la progresión del tumor. Sin embargo, se necesitará más investigación para abordar si este fenómeno tiene relevancia clínica para el cáncer de próstata humano. Además, queda por determinar de manera convincente si la neurogénesis en humanos normalmente persiste en la zona subventricular a lo largo de la vida, por lo que puede ser que los mecanismos que impulsan la neo-neurogénesis en humanos sean diferentes de los observados en los sistemas estudiados. Además, el modelo de ratón Hi-myc podría no ser suficiente para modelar todos los tipos de cáncer de próstata. Si ese es el caso, sería útil probar otros modelos de ratón, para determinar si estos hallazgos reflejan un mecanismo general o uno que es específico para este modelo en particular.
A pesar de estas incógnitas, el estudio de Mauffrey y sus colegas indudablemente proporciona una explicación para los orígenes de las células nerviosas recién formadas en los tumores de próstata en ratones. Pero no se puede descartar la posibilidad de que algunas de estas células nerviosas surjan espontáneamente de otros tipos de células del tumor o de sus alrededores. Sin embargo, los hallazgos de los autores merecen una mayor investigación para esclarecer los detalles de los mecanismos responsables. Por ejemplo, ¿cómo se inicia una ruptura de la barrera hematoencefálica de forma específica para la zona subventricular? Las respuestas a esta y otras preguntas deberían ayudar a aclarar este fascinante tema.
Fuente bibliográfica
Nerve cells from the brain invade prostate tumours
Simon T. Schafer & Fred H. Gage
The Salk Institute for Biological Studies, La Jolla, California 92037, USA.
DOI: 10.1038/d41586-019-01461-7