Los inéditos eventos del cáncer prostático
Los estudios de secuenciación del genoma completo han revelado la presencia de duplicaciones de una región reguladora -potenciadora- en el gen codificante para el receptor de andrógenos (RA) en el cáncer de próstata humano resistente al tratamiento. El hallazgo muestra la importancia de analizar las regiones de ADN no codificantes para proteínas y su rol en procesos tan relevantes como el desarrollo de resistencia tumoral. La revolución genómica que comenzó con el Proyecto del Genoma Humano está llegando a la cúspide con una ola de estudios genómicos específicos que investigan cómo el cáncer evoluciona durante el tratamiento. Tal progreso representa un paso más hacia la era de la medicina de precisión para la terapia contra el cáncer.
Amplificación de potenciadores
La publicación de la secuencia del genoma humano en 2001 fue acompañada por el optimismo de que un aumento en la disponibilidad de datos genómicos podría mejorar los tratamientos clínicos. Se esperaba que tales datos pudieran algún día permitir un enfoque llamado "medicina de precisión", en el que las terapias se adapten para tratar las anomalías específicas de un cáncer en particular. Desde entonces, los avances tecnológicos en las técnicas de secuenciación del ADN, combinados con costos sustancialmente más bajos, han llevado a un auge en la secuenciación de las muestras de cáncer. Dado este progreso, se podría asumir que las alteraciones genéticas clave que conducen a los cánceres comunes ya son bien conocidas. Sin embargo, recientes estudios detallan un tipo de alteración genética no identificada previamente que ocurre con frecuencia en el cáncer de próstata en etapa tardía.
El Atlas del Genoma del Cáncer (TCGA, por sus siglas en inglés) y el Consorcio Internacional del Genoma del Cáncer (ICGC, por sus siglas en inglés) han emprendido algunos de los proyectos de mayor envergadura hasta ahora para secuenciar el ADN del cáncer en humanos. Estos esfuerzos han identificado muchas alteraciones en el ADN que impulsan el crecimiento tumoral, incluyendo mutaciones y reorganizaciones genómicas. El TCGA ha secuenciado las regiones codificantes de proteínas de aproximadamente 11.000 genomas individuales y 33 tipos de cáncer (https://portal.gdc.cancer.gov), mientras que el ICGC ha secuenciado las regiones codificantes de más de 20.000 genomas individuales y 22 tipos de cáncer (https://dcc.icgc.org). Ambos proyectos se han centrado principalmente en la secuenciación de las regiones codificantes, las que representan menos del 2% de todo el genoma. En el proyecto Pan Cancer Analysis of Whole Genomes (PCAWG), el ICGC y el TCGA analizaron sistemáticamente los datos de secuenciación del genoma completo de muchos tipos de cáncer. Estos datos permitieron a los científicos investigar las alteraciones en las regiones del ADN que regulan la expresión génica y en secuencias génicas no traducidas. Esto reveló que, en las células cancerosas, las alteraciones de no codificantes ocurren con una frecuencia similar a las de las regiones codificantes de proteínas.
Muchos de los estudios de secuenciación reportados por el TCGA y el ICGC se centraron predominantemente en muestras tumorales tomadas de pacientes antes del tratamiento contra el cáncer. El trabajo de Takeda (DOI: 10.1016/j.cell.2018.05.037), Viswanathan (DOI: 10.1016/j.cell.2018.05.036), Quigley (DOI: 10.1016/j.cell.2018.06.039) y sus respectivos colaboradores proporciona información sobre las alteraciones genéticas presentes en los cánceres de próstata resistentes al tratamiento clínico.
El crecimiento del cáncer de próstata suele estar impulsado por vías de señalización que actúan a través del receptor de andrógenos (RA), y un tratamiento clínico estándar para el cáncer de próstata avanzado es reducir el nivel de hormonas androgénicas que activan los RA. Aunque esto limita el crecimiento del cáncer por un tiempo, los tumores eventualmente se vuelven resistentes a esta terapia, y surge una forma altamente maligna del cáncer que generalmente es letal. Este tipo de tumor puede migrar a otras partes del cuerpo y este tipo de tumor de etapa tardía y resistente al tratamiento se denomina cáncer de próstata metastásico resistente a la castración.
Cuando se presenta resistencia al tratamiento, es frecuente encontrar en el tumor una versión alterada del gen que codifica para el RA. Las mutaciones en este gen o las amplificaciones del ADN que aumentan las copias de su secuencia podrían permitir a las células tumorales potenciar la señalización de la vía RA incluso cuando los niveles de andrógenos son bajos. Los análisis de los cambios en la secuencia de codificación de proteínas relacionados con el cáncer de próstata han encontrado alteraciones en el RA, así como en otros genes conocidos que promueven el cáncer. Aunque una gran cantidad de datos de secuenciación de ADN de las regiones que codifican proteínas están disponibles para las muestras de cáncer de próstata, comparativamente existen pocas secuencias de genoma completo (sólo aproximadamente 200 han sido reportadas por el proyecto PCAWG, por ejemplo; https://dcc.icgc.org/pcawg), y aún menos datos de secuenciación de genoma completo están disponibles para el cáncer de próstata metastásico, resistente a la castración.
Takeda y sus colegas reevaluaron datos previamente publicados de muestras clínicas de cáncer de próstata resistente a la castración e identificaron secuencias repetidas de ADN que causaron amplificación anormal de la región río arriba del RA (figura 1). Los autores describen esta región como un tipo de elemento regulador de genes llamado potenciador (enhancer), que es una secuencia que puede ayudar a promover la expresión génica. Cuando Takeda y sus colegas utilizaron una técnica de edición del genoma para atacar y suprimir esta región en células humanas de cáncer de próstata cultivadas in vitro, tanto la proliferación celular como la expresión de RA se redujeron. Los autores también diseñaron células de cáncer de próstata cultivadas in vitro para contener una duplicación del potenciador, y encontraron que dichas células mostraban una mayor expresión de RA y una menor sensibilidad a un fármaco dirigido a RA: enzalutamida, que es usado para tratar el cáncer de próstata metastásico resistente a la castración.
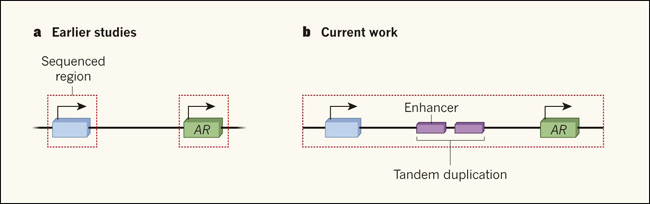
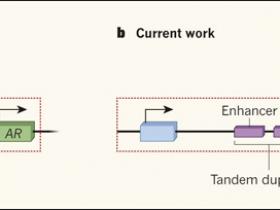
Figura 1. La duplicación de una región potenciadora del genoma ocurre con frecuencia en el cáncer de próstata.
a, Muchos de los estudios previos sobre secuenciación de ADN del cáncer de próstata humano se han enfocado en regiones que codifican las proteínas, como el gen que se muestra en azul (el recuadro rojo punteado indica regiones secuenciadas). En este trabajo se identificaron alteraciones en la secuencia del gen del receptor de andrógenos (RA), como un conductor común de la progresión de la enfermedad. b, Los grupos de investigación de Takeda (DOI: 10.1016/j.cell.2018.05.037), Viswanathan (DOI: 10.1016/j.cell.2018.05.036) y Quigley (DOI: 10.1016/j.cell.2018.06.039), demuestran la utilidad de los enfoques de secuenciación que no se limitan a las regiones codificantes, y las ventajas de la secuenciación de muestras tumorales que se han vuelto resistentes a la terapia como una forma de investigar por qué el tratamiento clínico finalmente fracasa. Los tres estudios de cáncer de próstata en etapa tardía reportan que la secuencia de ADN en una zona río arriba del gen de RA, (enhancer, potenciador) comúnmente se encuentra expandida y esta amplificación es a menudo en la forma de duplicación en tándem. Una amplificación potenciadora puede impulsar la expresión de RA, lo que permitiría a los tumores eludir los efectos de los tratamientos clínicos que se dirigen a la vía de señalización de este receptor.
Viswanathan y colegas presentan datos de secuenciación de genoma completo para 23 muestras de cáncer de próstata metastásico y resistente a la castración. Los autores compararon estos datos de secuenciación con datos de células no cancerosas de estos individuos. Esto permitió a los investigadores reportar las alteraciones que caracterizan a este tipo de cáncer. Éstas incluían numerosas secuencias duplicadas, muchas de ellas ocurridas en tándem. Estas duplicaciones en tándem con frecuencia ocurrieron en secuencias genómicas adyacentes al gen del RA y a otro gen promotor del cáncer llamado MYC. La principal región de amplificación de secuencia asociada con RA estaba en la misma región potenciadora que fue identificada por Takeda y sus colegas. Viswanathan y sus colegas encontraron que la amplificación de la secuencia enhancer estaba presente en el 87% de sus muestras, ya sea con o sin una copia amplificada del gen de RA.
Quigley y sus colegas realizaron la secuenciación de genoma completo de 101 muestras de tejido prostático metastásico, resistente a la castración, obtenido de estudios previos. El sitio genómico más frecuentemente alterado identificado fue la región del potenciador de RA, que estuvo amplificada en el 81% de las muestras. La alta prevalencia de este tipo de alteraciones es notable porque las amplificaciones de potenciadores identificadas hasta ahora para otros tipos de cáncer generalmente surgen con una frecuencia mucho más baja. Además, la alta prevalencia de esta amplificación del enhancer de RA en los datos presentados por Viswanathan y Quigley contrasta con su ocurrencia en sólo 1 de las 54 secuencias de cáncer de próstata previamente publicadas. Sin embargo, queda por determinar si la amplificación de esta región suele surgir en el momento en que los cánceres se vuelven resistentes al tratamiento, o si esta alteración ya está presente en un subconjunto de células tumorales antes de que el tumor deje de responder al tratamiento.
Quigley y su grupo no informaron ninguna correlación entre la presencia o ausencia de la amplificación del potenciador de RA ni tampoco si el cáncer había progresado hasta la etapa en la que el paciente recibió un segundo tipo de tratamiento antiandrogénic, como enzalutamida, después del fracaso de tratamiento de primera línea. Viswanathan y sus colegas presentaron datos de secuenciación de tres pacientes para los que se dispuso de muestras tumorales antes y después del tratamiento de segunda línea con antiandrógenos con enzalutamida.Estos datos revelaron que las muestras de después del tratamiento tenían una amplificación de RA y del potenciador de RA. Si los datos adicionales de los pacientes indican una conexión entre la amplificación del intensificador de RA y la aparición de resistencia al tratamiento, tal vez esta amplificación podría ser monitorizada como un biomarcador de la progresión de la enfermedad. Viswanathan y sus colegas demostraron que tales alteraciones podrían rastrearse a través del análisis del ADN tumoral circulante de los pacientes.
Estos estudios destacan tres aspectos importantes de la forma en que el análisis genómico podría iluminar la comprensión de cómo los cánceres desarrollan resistencia a la terapia. En primer lugar, estudiar las muestras tumorales obtenidas de los pacientes antes y durante el tratamiento podría ser la mejor manera de entender cómo se desarrolla la resistencia. En segundo lugar, analizar una serie de muestras de pacientes, como biopsias o ADN tumoral aislado de muestras de sangre, podría ayudar a revelar si surgen alteraciones cruciales del ADN durante el tratamiento o si ya estaban presentes en un subconjunto de células tumorales previamente. El trabajo de Quigley y sus colegas con una gran cantidad de muestras de pacientes solo aborda parcialmente esto. El análisis de los pacientes a lo largo del tiempo también puede ayudar a determinar cuándo se debe modificar la terapia para tratar de prevenir el desarrollo de una enfermedad resistente al tratamiento. En tercer lugar, las tecnologías disponibles para detectar cambios genómicos están mejorando rápidamente, y los enfoques de secuenciación utilizados en los estudios actuales pueden detectar alteraciones complejas del ADN que han sido particularmente difíciles de determinar mediante el uso de técnicas anteriores.
Fuente bibliográfica
Sequence of events in prostate cáncer
Kellie A. Cotter & Mark A. Rubin
Department for BioMedical Research, University of Bern, CH-3008 Bern, Switzerland, and at Inselspital, Bern, Switzerland.
DOI: 10.1038/d41586-018-06029-5
Temas Relacionados