Las redes patogĂŠnicas de la fibrosis
El envejecimiento promueve la inflamaciĂłn, un proceso que contribuye a la fibrosis y disminuciĂłn funcional de los Ăłrganos. La investigaciĂłn biolĂłgica sobre esta materia ha permitido determinar que la liberaciĂłn de trampas extracelulares (NET) desde neutrĂłfilos, proceso denominado NETosis es orquestada por una enzima llamada peptidil arginina desaminasa 4 (PAD4), y contribuye al deterioro de Ăłrganos en modelos animales para el estudio de procesos inflamatorios agudos. Se determinĂł que la NETosis es mĂĄs prevalente en ratones de edad avanzada y se investigĂł el papel de PAD4 / NET en la fibrosis de Ăłrganos relacionados con la edad. Los autores observaron una mayor reducciĂłn de la fibrosis en los corazones y pulmones de roedores envejecidos que no expresaban la enzima, en comparaciĂłn con ratones de tipo salvaje (WT). Interesantemente, se observĂł un incremento en la deposiciĂłn de colĂĄgeno intersticial en el ventrĂculo izquierdo y un descenso en la funciĂłn sistĂłlica y diastĂłlica solo en ratones WT, y no en ratones PAD4 -/-. En un modelo experimental de fibrosis cardĂaca, la sobrecarga de presiĂłn indujo NETosis y un reclutamiento plaquetario significativo en animales WT pero no en roedores PAD4 -/-. Por lo tanto, estos hallazgos postulan la inhibiciĂłn de la enzima PAD4 como una posible opciĂłn terapĂŠutica y dan a conocer un papel relevante de las NET en la fibrosis cardĂaca y disfunciĂłn de Ăłrganos asociada con la edad.
Trampas celulares
La fibrosis involucra una deposiciĂłn excesiva de matriz extracelular durante un proceso reparativo o reactivo tras un daĂąo tisular. Tal evento, que puede ocurrir durante la inflamaciĂłn crĂłnica y el envejecimiento, contribuye sustancialmente a la enfermedad y a la muerte. Afecta Ăłrganos esenciales como el corazĂłn, los pulmones, y el hĂgado. En el corazĂłn, la fibrosis contribuye a fallas sistĂłlicas y diastĂłlicas. Por otro lado, las opciones de tratamiento actual para los trastornos fibrĂłticos son escasas y la mayorĂa de las estrategias que se han probado no han tenido ĂŠxito. Recientemente, Kimberly Martinod y sus colegas (J Exp Med. 2017 Feb;214(2):439-458) han postulado nuevas ideas sobre los mecanismos subyacentes a la fibrosis tisular, lo que podrĂa ofrecer nuevos enfoques para abordar o prevenir esta patologĂa.
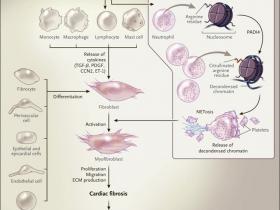
Los miofibroblastos son las cÊlulas efectoras primarias en la remodelación tisular y la fibrosis. Se piensa que pueden originarse a partir de cÊlulas mesenquimales y de pericitos (cÊlulas contråctiles que envuelven la superficie externa de los capilares y vÊnulas). TambiÊn se generan por medio de la transdiferenciación de cÊlulas derivadas del epitelio y del epicardio (transición epitelial a mesenquimal), cÊlulas  endoteliales y de precursores derivados de la mÊdula ósea (Figura 1).
Actualmente, se conocen ciertos factores desencadenantes de la fibrosis. La inflamaciĂłn crĂłnica activa miofibroblastos por medio de la regulaciĂłn positiva de la  citoquinas proinflamatorias, factores de crecimiento fibrogĂŠnicos y especies reactivas de oxĂgeno liberadas por una variedad de cĂŠlulas invasoras, incluyendo las hematopoyĂŠticas, epicĂĄrdicas, endoteliales y mieloides. AdemĂĄs, el envejecimiento se asocia con un aumento de la incidencia y gravedad de la fibrosis de Ăłrganos, la que parece estar causada, al menos en parte, por un desequilibrio entre las respuestas inmunes adaptativas innatas. Las seĂąales inflamatorias orquestan la activaciĂłn de los miofibroblastos locales para producir una excesiva matriz extracelular. Los miofibroblastos activados migran, proliferan, se diferencian y causan daĂąo al tejido al liberar matriz extracelular y citoquinas, generando un bucle patogĂŠnico de retroalimentaciĂłn positiva.
El reciente estudio de Martinod implica la participaciĂłn de neutrĂłfilos en la fibrosis cardĂaca y pulmonar. Los neutrĂłfilos activados forman trampas de neutrĂłfilos (NETs) en un proceso denominado NETosis, que en general actĂşa como mecanismo de defensa antimicrobiano al inmovilizar y eliminar a los microorganismos invasores. Estas trampas estĂĄn formadas por cromatina (un complejo ADN - proteĂna), que se libera de la cĂŠlula moribunda - en este caso, el neutrĂłfilo, aunque otros tipos celulares tambiĂŠn pueden emplear la NETosis.
Los autores determinaron que la NETosis se activa durante el envejecimiento y tiene un papel en la fibrosis cardiopulmonar. Lo central en su trabajo fue la conclusiĂłn anterior de que la NETosis estĂĄ mediada por la enzima peptidil arginina desaminasa tipo IV la cual aĂąade un aminoĂĄcido (citrulina) a residuos especĂficos de arginina en los complejos histona - proteĂna alrededor de las que se enrolla el ADN. La citrulinaciĂłn de histonas induce la descondensaciĂłn de la cromatina, requerida para la liberaciĂłn de NETs.
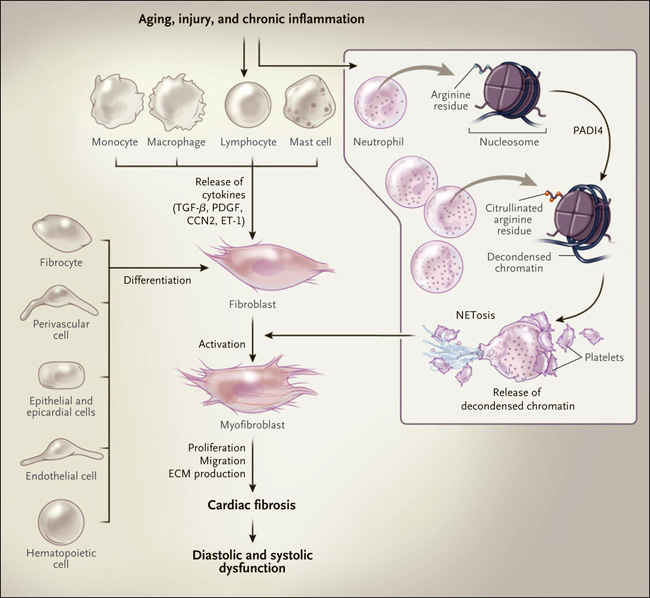
Figura  1: Modelo de la patogĂŠnesis molecular de la fibrosis cardĂaca.Â
Los miofibroblastos se originan a partir de diversos tipos celulares y son activados por muchos actores celulares y moleculares, incluyendo las citoquinas como el factor de crecimiento transformante β (TGF-β), factor de crecimiento derivado de plaquetas (PDGF), el factor de crecimiento de tejido conectivo (CCN2) y endotelina 1 (ET-1). Los neutrĂłfilos contribuyen a la activaciĂłn de miofibroblastos mediante NETosis, en la que la enzima peptidil arginina desaminasa tipo IV (PADI4) aĂąade citrulina a los residuos de arginina en las colas de las histonas, lo que permite la liberaciĂłn de cromatina descondensada concomitante con la activaciĂłn de complejos neutrĂłfilos-plaquetas (inserciĂłn). Los miofibroblastos activados liberan proteĂnas de matriz extracelular (MEC) que contribuyen a la fibrosis y a insuficiencia cardĂaca.
Martinod y colaboradores usaron ratones deficientes en la enzima PADI4 (padi4 - / -) Â para determinar la relevancia de esta enzima, y su rol en la NETosis y fibrosis tisular. Encontraron que los roedores padi4 - / - son resistentes a la fibrosis cardĂaca inducida por la edad, lo que conduce a la prevenciĂłn sistĂłlica y diastĂłlica. Asimismo, la incidencia de fibrosis pulmonar inducida por edad fue menor entre los ratones padi4 - / - que entre los ratones tipo silvestre (wildtype) lo que sugiere un papel general de esta vĂa enzimĂĄtica en la fibrosis de Ăłrganos asociada a la edad. El efecto protector no solo se observĂł durante el envejecimiento sino que tambiĂŠn cuando ratones control fueron sometidos a una sobrecarga de presiĂłn, lo que induce fibrosis. Debido a que PADI4 estĂĄ altamente expresada en cĂŠlulas inflamatorias y presenta niveles muy bajos en corazĂłn y pulmĂłn, los autores postulan que una reducciĂłn de la NETosis de neutrĂłfilos probablemente subyace al fenotipo observado.
De hecho, aunque los recuentos de neutrĂłfilos y plaquetas fueron elevados de manera similar en ratones control y padi4 - / -, este tipo celular en ratones tipo silvestre de edad avanzada fue promotor de la NETosis. Finalmente, en el modelo de sobrecarga de presiĂłn, el aumento de NETosis en presencia de PADI4 fue paralela a un mayor reclutamiento de neutrĂłfilos y plaquetas al corazĂłn, promoviendo la fibrosis mediante daĂąo colateral inflamatorio y la entrega de TGF-β. Es plausible que un inhibidor de NETosis (por ejemplo, un inhibidor de PADI4) pudiera interferir con las respuestas reparativas de los neutrĂłfilos, no sĂłlo en el contexto de los principales daĂąos agudos en los tejidos, como la miocarditis o lesiones pulmonares infecciosas, sino tambiĂŠn en contexto de lesiones menores y continuas durante el envejecimiento.
Intrigantemente, la reciente identificaciĂłn de monocitos atĂpicos con caracterĂsticas de granulocitos, como progenitores crĂticos para la fibrosis, que en general no participan de los procesos proinflamatorios, destaca el potencial de desarrollo de nuevos fĂĄrmacos antifibrĂłticos que no comprometan la respuesta inflamatoria reparativa despuĂŠs de una lesiĂłn. Sin embargo, debido a que las respuestas a las lesiones tisulares varĂan dependiendo del tipo de lesiĂłn, el contexto de la enfermedad, y posiblemente entre especies, y dado que son procesos estrechamente controlados con respecto al momento de reclutamiento y retenciĂłn de cĂŠlulas invasoras, se necesitarĂĄn de estudios adicionales para descifrar los efectores inflamatorios y comprender su control temporal en el contexto de la enfermedad fibrĂłtica en los seres humanos.
Fuente bibliográfica
Netting Insights into Fibrosis
Stefanie Dimmeler, Ph.D., and Andreas M. Zeiher, M.D.
Center of Molecular Medicine, University of Frankfurt.
DOI: 10.1056/NEJMcibr1616598
Temas Relacionados