La ruta de la diferenciación ósea y adiposa
Las células madre mesenquimales (CMM) constituyen poblaciones de células multipotentes mesodérmicas implicadas en la regeneración de tejidos y la homeostasis de muchos órganos diferentes. En esta publicación se da a conocer una caracterización completa de los cambios transcripcionales y epigenómicos asociados con la diferenciación de osteoblastos y adipocitos a partir de CMM humanas. Se demuestra que la adipogénesis es impulsada por una considerable remodelación de la cromatina y la activación de novo de los potenciadores de la transcripción, mientras que la osteogénesis implica la activación de potenciadores preestablecidos, lo que indica que la determinación del linaje es un delicado equilibrio entre las actividades de muchos factores y elementos transcripcionales diferentes.
Células madre mesenquimales
Las células madre y las células progenitoras residen en varios tejidos del cuerpo y son capaces de generar células hijas de diferentes linajes. Las células madre mesenquimales (CMM) son células estromales multipotentes que residen en tejidos como la médula ósea, el tejido adiposo, el hígado y el músculo esquelético. Actualmente, se sabe que las CMM contribuyen a la reparación tisular y son capaces de diferenciarse en osteoblastos (hueso), adipocitos (grasa) o condrocitos (cartílago). La forma en que una CMM genera células de fenotipos completamente diferentes ha sido un misterio. Sin embargo, un estudio reciente de Alexander Rauch y colaboradores proporciona algunas pistas que tienen repercusiones para nuestra comprensión de la obesidad y los trastornos de la mineralización ósea (Nat Genet. 2019 Apr;51(4):716-727).
En su estudio, Rauch y sus colegas aislaron CMM humanas de la médula ósea y del tejido adiposo y luego las trataron en laboratorio con un cóctel de productos químicos que se sabe que inducen la diferenciación tejido adiposo y óseo. Observaron que la diferenciación adipogénica estaba asociada con un cambio en la expresión de un mayor número de genes que la diferenciación osteoblástica, y que la magnitud de la inducción de los primeros genes adipogénicos específicos era mucho mayor que la de los genes osteoblásticos específicos. Los autores atribuyeron estas diferencias al hecho de que las CMM indiferenciadas se parecían más al osteoblasto que al adipocito. La mayor parte de la maquinaria de expresión génica utilizada por las CMM para la diferenciación en un osteoblasto ya están activadas. Por el contrario, la diferenciación en un adipocito implica la expresión de un conjunto completamente nuevo de genes junto con el silenciamiento de aquellos que estaban activos en las CMM indiferenciadas.
Para obtener una idea de los mecanismos moleculares de especificación e inducción de genes adipogénicos u osteogénicos, los investigadores observaron segmentos de ADN llamados potenciadores, que regulan la transcripción y por lo tanto la expresión de un gen. Los potenciadores pueden estar presentes en cientos o miles de bases río arriba o río abajo del gen y pueden ser considerados como amplificadores de la expresión génica. Cuando los potenciadores están en posición abierta, permiten fácilmente la unión de proteínas llamadas factores de transcripción, y los elementos potenciadores junto con las proteínas unidas interactúan con los elementos del gen para aumentar la expresión. Por el contrario, cuando los potenciadores están en una posición cerrada, los factores de transcripción no pueden unirse a ellos, y la expresión génica se atenúa. Los autores observaron que los potenciadores que regulan la expresión de genes específicos de los osteoblastos, como la fosfatasa alcalina asociada a la biomineralización (ALPL), ya estaban en una posición abierta en las CMM indiferenciadas, lo que permitía un fácil acceso a los factores de transcripción y diferenciación en un osteoblasto. En contraste, los potenciadores que regulan la expresión de genes adipogénicos clave estaban en una posición cerrada, y la diferenciación adipogénica implicaba una remodelación extensa de la cromatina para llevar a estos potenciadores a una posición abierta. De esta forma, los obstáculos o barreras genéticas que las MCC deben superar para convertirse en adipocitos son mucho mayores que los que debe superar para convertirse en osteoblasto.
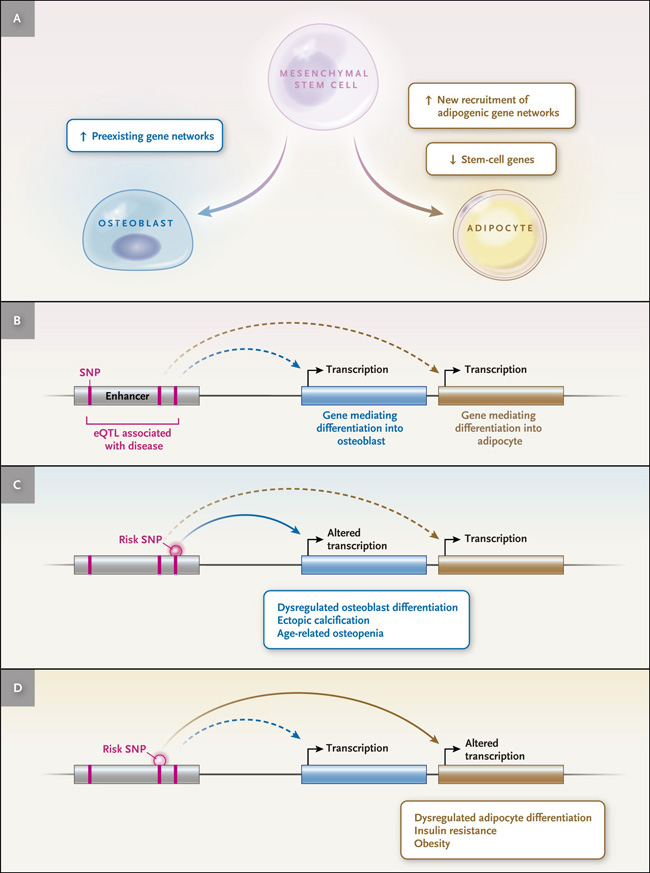
Figura 1. Diferenciación de células madre mesenquimales humanas en osteoblastos o adipocitos e implicaciones para las enfermedades.
El panel A muestra la diferenciación de células madre mesenquimales humanas (MSCs) en osteoblastos, un proceso que implica principalmente la activación de redes de genes preexistentes, y la diferenciación adipogénica, un proceso que implica la remodelación de la cromatina con la activación de nuevos potenciadores, el reclutamiento de genes adipogénicos y el silenciamiento simultáneo de genes de células troncales. Los paneles B a D muestran modelos de cómo la diferenciación de MSC no regulada puede asociarse con enfermedades humanas del hueso y del tejido adiposo: el panel B muestra cómo los polimorfismos de nucleótido único (SNP) asociados a la enfermedad y los loci de rasgos cuantitativos de expresión (eQTL) que afectan a las regiones potenciadoras pueden inhibir o aumentar la diferenciación adipogénica u osteogénica; el panel C, cómo la diferenciación de osteoblastos no regulada puede asociarse con la calcificación ectópica o la osteopenia relacionada con la edad; y el panel D, cómo la diferenciación adipogénica no regulada puede asociarse con la resistencia a la insulina o la obesidad.
Los potenciadores identificados por los autores parecen ser clínicamente relevantes. Las variaciones en la secuencia del genoma humano pueden asociarse con diferencias cuantitativas en el grado de expresión de los genes en diversos tejidos. Estos loci genómicos que determinan diferencias en el grado de expresión de un gen en particular se conocen como loci de rasgos cuantitativos de expresión. Los autores observaron que los loci de rasgos cuantitativos de expresión que se sabe que afectan la expresión de los genes osteogénicos y adipogénicos en los humanos se enriquecen abundantemente en los potenciadores que regulan la diferenciación adipogénica y osteogénica. En este sentido, los polimorfismos de nucleótido único (SNP) asociados con enfermedades humanas de función adiposa u ósea también se enriquecen sustancialmente en potenciadores que muestran activación dinámica durante la diferenciación adipogénica u osteogénica. Por lo tanto, los SNP que interrumpen la función potenciadora o las redes de expresión génica que impulsan la adopción de destinos adipogénicos u osteogénicos podrían causar o afectar el fenotipo de la enfermedad. Utilizando enfoques computacionales, los autores identificaron 12 factores de transcripción clave que estaban altamente expresados y que se podían unir a motivos específicos (secuencias de ADN) en las regiones potenciadoras y regular la expresión de genes que impulsan la adipogénesis o la osteogénesis.
El silenciamiento de esos factores de transcripción inhibió significativamente la diferenciación de la CMM en un osteoblasto, disminuyó la expresión de ALPL y atenuó la mineralización. Al mismo tiempo, el silenciamiento de estos factores de transcripción aumenta la adipogénesis y la acumulación de lípidos; esto muestra cómo la especificación de una célula madre adulta humana para adoptar un destino celular puede ser simplemente alterada por la modulación de los factores de transcripción. Los autores observaron una expresión variable de estos factores en muestras de biopsia de hueso o tejido adiposo humano o en CMM y preadipocitos obtenidos de pacientes con obesidad, osteoporosis o disfunción relacionada con la edad, un hallazgo que corrobora la relevancia clínica de sus observaciones generales.
Las principales conclusiones del estudio, cuando se sitúan en el contexto clínico, tienen implicaciones para la biología de las CMM humanas y la fisiología del hueso y tejido adiposo en la salud y enfermedad. La calcificación ectópica es una afección patológica frecuente que provoca la mineralización de los tejidos blandos, como las válvulas cardíacas, vasos sanguíneos y el músculo esquelético. En los tejidos afectados, se cree que las células del estroma sobrerregulan los genes osteogénicos, se diferencian en un fenotipo osteogénico y contribuyen a la mineralización. Las conclusiones de Rauch y sus colegas sugieren que la maquinaria de regulación génica ya está cebada en dichas células para adoptar destinos osteogénicos, y esto crea un entorno permisivo para que las células del estroma asuman destinos osteogénicos en respuesta a las señales ambientales. Por el contrario, los defectos o el retraso en la cicatrización de una fractura podrían ser causados por la incapacidad o el mal funcionamiento de dichas redes de genes para impulsar eficazmente a las CMM a adoptar destinos de células osteogénicas.
El envejecimiento y la obesidad inducen la acumulación de adipocitos ectópicos en la médula ósea, un proceso que afecta la regeneración hematopoyética y osteogénica. Específicamente, se sabe que el envejecimiento inhibe el linaje osteogénico (osteopenia relacionada con la edad), mientras que una dieta alta en grasas promueve la expansión adipogénica. Los autores proporcionan una plataforma racional para comprender y abordar estos cambios relacionados con la edad, en los que las señales ambientales o los factores genéticos que afectan a un grupo central de potenciadores o factores de transcripción serían suficientes para llevar a las CMM de la médula ósea a un destino específico y contribuir a un fenotipo patológico (figura 1). Los factores de transcripción que activan los potenciadores osteogénicos o adipogénicos, destacados en el estudio, muestran cambios en la expresión en varios estados patofisiológicos como la osteoporosis, obesidad, resistencia a la insulina y envejecimiento. Una investigación detallada de tales factores de transcripción y genes que comprometen el linaje proporcionará un camino experimental para la identificación potencial de dianas terapéuticas para la obesidad, osteopenia relacionada con la edad y la calcificación ectópica.
Fuente bibliográfica
How Stem Cells Turn into Bone and Fat
Arjun Deb, M.D.
Departments of Medicine and Molecular Cell and Developmental Biology, Eli and Edythe Broad Center of Regenerative Medicine and Stem Cell Research, University of California, Los Angeles.
DOI: 10.1056/NEJMcibr1905165