Estrés mitocondrial para vivir más
Los organismos responden al estrés de este organelo a través de la regulación de una serie de genes protectores, a menudo promoviendo una respuesta temprana frente a alteraciones metabólicas, lo cual ocurre a lo largo de toda la vida. Sin embargo, recientes estudios han encontrado que el estrés mitocondrial provoca cambios generalizados en la estructura de la cromatina por medio de marcas químicas en las histonas, como las metilaciones, que tradicionalmente se asocian con el silenciamiento de genes. La activación de la respuesta frente al daño de la mitocondria requiere de estas modificaciones en residuos aminoacídicos específicos de las histonas, con lo que la cromatina sufre un remodelamiento de manera que permite la unión de factores de transcripción que propician la expresión de genes encargados de mitigar el estímulo estresante e increíblemente permitir la prolongación de la vida en modelos de estudio eucariontes.
Regulación génica y estrés
Las mitocondrias son cruciales para la generación de moléculas de ATP, fuente energética de las células. Se ha observado que un deterioro mitocondrial leve en gusanos juveniles Caenorhabditis elegans, modelo de estudio eucarionte, aumenta la esperanza de vida. Tal disfunción desencadena la señalización de múltiples vías incluyendo la denominada respuesta mitocondrial a proteínas desplegadas (UPRmt, por sus siglas en inglés), lo que causa cambios en la expresión génica de forma que las células y los organismos puedan hacer frente al estrés. En dos recientes publicaciones Tian y su equipo (Cell. 2016 May 19;165(5):1197-208) y Merkwirth y sus colegas (Cell. 2016 May 19;165(5):1209-23) identificaron los factores que retransmiten esta alteración mitocondrial hacia esta respuesta al estrés tan conservada entre eucariontes como gusanos, levaduras y mamíferos.
Los cambios en la expresión génica son en gran parte provocados por las alteraciones en la fuerza con la que el ADN está empaquetado alrededor de las proteínas histonas en una estructura llamada cromatina. La regulación de la cromatina se logra, en parte, a través de modificaciones químicas sobre las histonas, modulando su ensamblaje. Los estudios actuales muestran que las enzimas modificadoras de histonas son fundamentales tanto en la respuesta al estrés ante proteínas desplegadas, como en la prolongación de la vida de C. elegans.
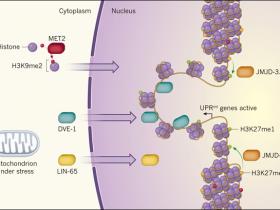
Mediante el uso de cribado genético, Tian y sus colegas encontraron que el gen lin-65 es esencial para la inducción de UPRmt en respuesta al estrés mitocondrial. Sin embargo, los autores también señalan que la esperanza de vida se amplió incluso en ausencia de lin-65, lo que sugiere que el estrés mitocondrial también induce otras vías que promueven longevidad. Los autores demostraron que el estrés mitocondrial causa la exportación de la proteína LIN-65 desde el citoplasma al núcleo, reminiscencia del regulador de UPRmt y factor transcripcional DVE-1, que también sufre una migración nuclear inducida por estrés. De hecho, los investigadores encontraron LIN-65 es requerida para la relocalización nuclear de DVE-1.
Tian y su equipo también proporcionaron pruebas que sugieren que la adición de dos grupos metilo al residuo aminoacídico lisina 9 de la histona H3 (una modificación apodada H3K9me2) que ocurre en el citoplasma gracias a la enzima MET2 metiltransferasa, desencadena la exportación nuclear de DVE-1. Sin embargo, no se puede descartar la posibilidad de que otros blancos no histónicos de metilación puedan estar involucrados en este proceso. Esto debido a que la sugerencia de los autores se basa en la inactivación metiltransferasa, lo que podría alterar la metilación de muchas otras proteínas además de las histonas. El mecanismo por el cual H3K9me2 promueve la migración nuclear de DVE-1 sigue siendo desconocido.
La modificación H3K9me2 se asocia generalmente con una cromatina fuertemente empaquetada. De hecho, Tian y sus colegas observaron que los núcleos celulares, en gusanos expuestos a estrés mitocondrial parecían ser más pequeños y más densos en comparación a los que no fueron sometidos a ese estímulo. La proteína DVE-1, localizada como puntos discretos a cierta distancia de regiones más densas de ADN, sugiere que este factor transcripcional se une preferentemente a secuencias que están menos empaquetadas. Esto apoya el modelo en el que el estrés, a través de H3K9me2, induce cambios en la remodelación de la cromatina que restringe el número de regiones de ADN en las que DVE-1 se puede unir para regular la transcripción. Por lo tanto, el estrés conduce a cambios específicos en la expresión de los genes (figura 1).
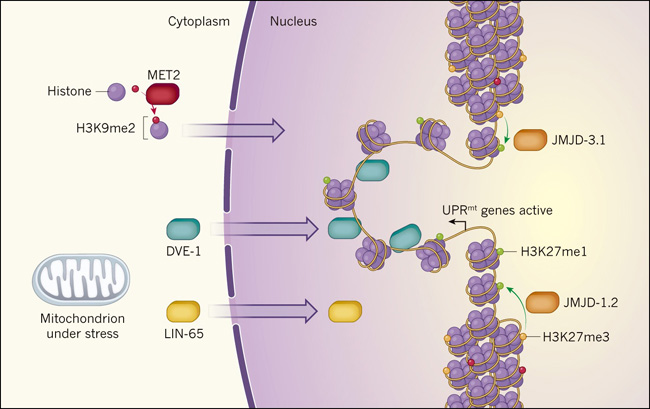
Figura 1. Respuestas mitocondriales coordinadas frente al estrés.
La expresión génica puede ser inhibida por un leve empaquetamiento del ADN como como la cromatina alrededor de las proteínas histonas, las que a su vez se encuentran "adornadas" con grupos metilo en residuos de aminoácidos específicos. Dos de estas modificaciones inhibitorias, se denominan H3K9me2 y H3K27me3. Recientemente, dos estudios han revelado que el estrés mitocondrial desencadena el desempaquetado y la expresión de genes involucrados a dar una respuesta a este estímulo (UPRmt). Tian y su equipo encontraron que el transporte de la proteína LIN-65 desde el citoplasma al núcleo desencadena la migración nuclear del factor de transcripción DVE-1. Las enzimas metil transferasas MET2 median la adición de modificaciones H3K9me2 a las histonas en el citoplasma. Tales histonas se mueven al núcleo, restringiendo las regiones donde DVE-1 se puede unir para promover la transcripción. Merkwirth y colegas muestran que las enzimas JMJD-1.2 y JMJD 3.1 son sobreexpresadas en respuesta al estrés mitocondrial y eliminan los grupos metilo desde el sitio H3K27me3 para formar una modificación que si promueve la transcripción (H3K27me1) en el entorno de los genes UPRmt.
En un estudio complementario, Merkwirth y sus colegas identificaron los genes jmjd-1.2 y jmjd-3.1 como componentes cruciales para la activación de la vía UPRmt y para la prolongación de la esperanza de vida de los gusanos con deterioro mitocondrial. Estos genes codifican enzimas que eliminan grupos metilo a partir de una modificación de las histonas apodada H3K27me3, que se asocia con la cromatina fuertemente empaquetada. El daño mitocondrial incrementa la expresión de estas dos histonas desmetilasas, lo que presumiblemente conduce al desempacamiento de la cromatina (figura 1). La sobreexpresión de jmjd-1.2 y jmjd 3.1en C. elegans recapitula muchos de los efectos del estrés mitocondrial leve, incluido el aumento de la longevidad y la inducción de una UPRmt, tal vez porque el incremento en los niveles de JMJD-1.2 y JMJD-3.1 reprime la expresión de muchos genes mitocondriales, perjudicando de este modo la función de este organelo celular.
En ambos estudios, los modificadores de histonas parecen ejercer sus efectos predominantemente en gusanos juveniles. Por lo tanto, es tentador especular que la cromatina es más receptiva a la reorganización inducida por el estrés en etapas tempranas de la vida y que estos cambios ayudan a establecer una respuesta al estrés que persiste en la edad adulta.
Las modificaciones en las histonas se pueden mantener de forma estable a lo largo de las divisiones celulares, incluso a través de las generaciones, haciéndolas buenos sustratos candidatos para una "memoria celular" de la disfunción mitocondrial. Es por este motivo que sería interesante determinar si la metiltransferasa H3K9me2 y la desmetilasa H3K27me3 son requeridas para el mantenimiento de la alteración mitocondrial inducida transcripcionalmente y la activación de la UPRmt hasta la edad adulta, incluso cuando el estímulo de estrés mitocondrial ya no está presente.
Debido a que se conoce que la regulación de la expresión génica es fundamental para la respuesta al estrés mitocondrial, la participación de modificadores de histonas no es un evento inesperado. Sin embargo, los estudios actuales sugieren que las enzimas modificadoras de la cromatina pueden ser altamente selectivas, desencadenando patrones de expresión génica específicos de un particular tipo de estrés. Los patrones de modificaciones de las histonas pueden ser muy diversos, por lo que no es difícil imaginar cómo puede surgir tan exquisita especificidad. De hecho, existen cientos de modificaciones de histonas y muchas enzimas que tienen funciones distintas y redundantes para realizar estos cambios. El ADN se enrolla alrededor de un nucleosoma complejo compuesto de cuatro histonas diferentes, y cada una se puede modificar en muchas posiciones, por lo que el número de modificaciones posibles es enorme en cada nucleosoma.
Ambos grupos encontraron que la regulación de la cromatina en respuesta al estrés mitocondrial mitocondrialel estrés es tejido específico. Tian y sus colegas mostraron que LIN-65 activa la vía UPRmt en el intestino, mientras que Merkwirth y su equipo reportaron que JMJD-1.2 y JMJD-3.1 gatillan la misma respuesta en las neuronas. Esto sugiere que los factores reguladores de la cromatina pueden censar el estrés mitocondrial en diferentes tipos celulares y responder de una forma divergente y coordinada, encontrando la mejor vía para que el organismo pueda contrarrestar el estrés. A futuro, será de gran relevancia explicar cómo las señales de estrés pueden estar acopladas a la regulación de la cromatina y cómo la regulación específica de un determinado tipo celular puede estar coordinada. Quizás el deterioro mitocondrial activa una vía de señalización que regula la expresión, los movimientos, modificaciones y actividades de diferentes modificadores histónicos en una célula específica. El daño del organelo celular también podría conducir a niveles alterados de intermediarios metabólicos, muchos de los cuales actúan como co-factores esenciales para las enzimas modificadoras de histonas.
La idea de que una señal de estrés pueda involucrar a modificadores específicos de histonas para provocar una respuesta persistente, sin duda, se puede extender a diversas fuentes de estrés. De hecho, JMJD-3.1 se ha visto involucrada en la amortiguación de una respuesta denominada de choque térmico, desde etapas juveniles hasta ejemplares más longevos de C. elegans. Adicionalmente, los subproductos del metabolismo celular como los radicales libres modulan la longevidad en otros modelos eucariontes como las levaduras, a través de una enzima modificadora de histonas. De esta forma, se puede asegurar que a futuro se encontrarán muchas otras pistas relevantes acerca del rol de la regulación de la cromatina frente al estrés.
Fuente bibliográfica
Physiology: Stressed-out chromatin promotes longevity.
Siu Sylvia Lee & Jessica K. Tyler.
Department of Molecular Biology and Genetics, Cornell University, Ithaca, New York 14850, USA.
Nature. 2016 Jun 29;534(7609):625-6
Temas Relacionados