Estrûˋs del retûÙculo: inductor de la inflamaciû°n
El estrûˋs del retûÙculo endoplasmûÀtico (RE) tiene un rol importante en patologûÙas inflamatorias, como la enfermedad de Crohn y la diabetes tipo 2.ô La inflamaciû°n se desencadena habitualmente cuando receptores como los tipo Toll o NOD detectan daûÝos en los tejidos o una infecciû°n microbiana. Sin embargo, el rol de estos û¤ltimos receptores intracelulares en la inducciû°n de esta respuesta durante el estrûˋs del retûÙculo no estûÀ clara. Recientemente, se han identificado, tanto en ratones como en cûˋlulas humanas, a dos receptores, NOD1 y NOD2, como importantes mediadores de la inflamaciû°n inducida por estrûˋs del organelo,ô lo que proporciona una nueva evidencia entre la inmunidad innata y la inflamaciû°n. Dado que varias patologûÙas relacionadas a procesos inflamatorios se asocian a un estrûˋs del retûÙculo en respuesta a infecciones bacterianas o de otro tipo, futuras terapias dirigidas a inhibir las vûÙas inflamatorias controladas por proteûÙnas NOD, serûÀn de gran ayuda para combatir estas complicaciones.ô
Respuesta a la infecciû°n
La capacidad de las cûˋlulas de mamûÙferos de reconocer y responder frente a patû°genos en las primeras etapas de una infecciû°n es crucial para la inmunidad. Se han identificado diversos receptores celulares del hospedero que son capaces de reconocer componentes microbianos conservados evolutivamente, tales como el peptidoglicano de la pared celular, el que rûÀpidamente activa el sistema inmune innato. Recientemente, Marijke Keestra-Gounder y colaboradores (Nature. 2016 Apr 21;532(7599):394-7) describieron una curiosa conexiû°n por medio de la cual, el estrûˋs en el retûÙculo endoplasmûÀtico (ER), compartimiento unido a la membrana responsable de la sûÙntesis de citoquinas secretadas, desencadena una seûÝal citoplasmûÀtica de "peligro" que conduce a la liberaciû°n de proteûÙnas inflamatorias que activan la respuesta innata. ô Aû¤n mûÀs sorprendente fue el hallazgo de que esta seûÝal de estrûˋs reticular es transducida a travûˋs de NOD1 y NOD2 - sensores que responden a fragmentos de peptidoglicanos - sin embargo, en estos casos, la respuesta se lleva a cabo en ausencia de estas molûˋculas bacterianas.
Una amplia variedad de agentes patû°genos secuestran y / o manipulan el RE celular. La infecciû°n a menudo activa el sistema de control de respuesta al estrûˋs propio del organelo, que corresponde al mecanismo denominado respuesta a proteûÙnas desplegadas (UPR, por sus siglas en inglûˋs). Investigaciones previas indican que la activaciû°n de IRE1α, enzima transmembrana del tipo quinasa requerida para la UPR, conduce a la inflamaciû°n, aunque los mecanismos implicados son poco conocidos. Para evitar la activaciû°n de la respuesta inmune, varios patû°genos bacterianos inhiben activamente este tipo de respuestas. Por el contrario, Brucella abortus, bacteria que causa aborto sûˋptico en el ganado, y que ocasionalmente infecta a seres humanos a travûˋs productos lûÀcteos contaminados, promueve activamente la inflamaciû°n inducida por la UPR por medio de la secreciû°n de su proteûÙna efectora VceC.
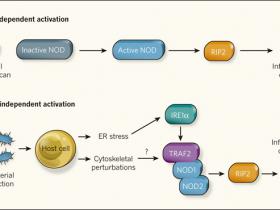
Keestra-Gounder y colegas, demostraron, utilizando ratones, que inhibiendo el estrûˋs del RE o la actividad sensora de IRE1αB durante una infecciû°n por B. abortus se reduce notablemente la producciû°nde de la citoquina IL-6 y otros mediadores de la respuesta inflamatoria. Por el contrario, gatillando la UPR en macrû°fagos de estos animales, ya sea con inductores quûÙmicos o mediante la expresiû°n de la proteûÙna de B. abortus, VceC, se evidencia una secreciû°n de IL-6. Sin embargo, se evidenciû° un giro importante cuando los investigadores estudiaron el mecanismo por el que la UPR desencadena la liberaciû°n de IL-6, identificando como requisito la presencia de NOD1 y NOD2. Keestra-Gounder y sus colegas encontraron que la inactivaciû°n genûˋtica de ambos receptores, o la supresiû°n rûÙo abajo de la enzima RIP2, reduce enormemente la seûÝalizaciû°n de citoquinas en respuesta al estrûˋs. Importantemente, estos sensores fueron activados en ausencia de molûˋculas microbianas, lo que implica que los receptores NOD pueden participar en la respuesta inflamatoria, dependiente o independientemente de la presencia de ligandos bacterianos (fig. 1).
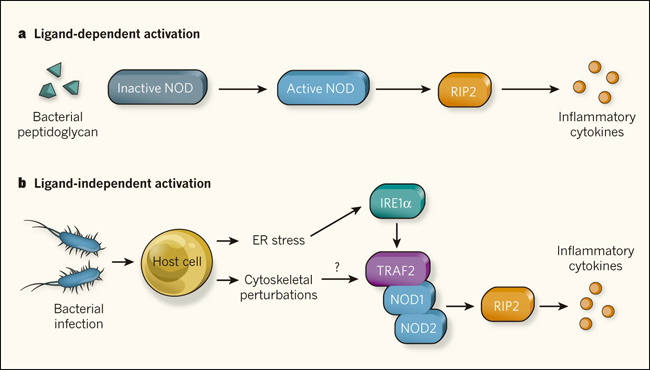
Figura 1. Las proteûÙnas NOD responden a una infecciû°n a travûˋs de distintas vûÙas.ô
a, NOD1 y NOD2 fueron inicialmente caracterizadas como receptores que responden a molûˋculas de peptidoglicano de bacterias en cûˋlulas infectadas, y que inducen la producciû°n de citoquinas inflamatorias a travûˋs de la activaciû°n de la enzima RIP2 quinasa. b, Keestra-Gounder y sus colegas muestran que el estado celular conocido como estrûˋs del retûÙculo endoplûÀsmico (RE), que es inducido por diversas infecciones bacterianas, genera una seûÝal de peligro que tambiûˋn se transmite por proteûÙnas NOD, incluso en ausencia de productos bacterianos. Los autores proponen que el estrûˋs del RE estimula la actividad de la enzima IRE1α y conduce a la formaciû°n de un complejo entre las enzimas TRAF2 y ô NOD1 / NOD2, iniciando la inflamaciû°n a travûˋs de la activaciû°n RIP2. Al comparar estos hallazgos con observaciones previas acerca de perturbaciones del citoesqueleto, objetivo comû¤n de patû°genos intracelulares, ô y cû°mo estas alteraciones tambiûˋn pueden generar una seûÝalizacion celular a travûˋs de NOD provocando inflamaciû°, se puede generar un modelo en el que las enzimas NOD son el eje central para retransmitir seûÝales que provienen directamente de ligandos bacterianos y de vûÙas de estrûˋs que indirectamente detectan el ataque de patû°genos en la cûˋlula.
Luego, los autores investigaron la inflamaciû°n mediada por la UPR in vivo durante una infecciû°n por B. abortus. Cuando trataron a hembras de ratones preûÝadas e infectadas esta especie, con la sal biliar el TUDCA, utilizado para mitigar los efectos del estrûˋs del RE, observaron un gran desenso de los niveles de inflamaciû°n en la placenta, y un aumento de la supervivencia de las crûÙas, sin un cambio en la carga de B. abortus. La bacteria, es transmitida generalmente entre los animales cuando una hembra es infectada, desarrollando una inflamaciû°n placentaria y sufriendo abortos espontûÀneos. El hallazgo de que B. abortus secreta una proteûÙna que desencadena una respuesta inflamatoria que afecta la placenta, sugiere que puede ser capaz de secuestrar los mecanismos que generan este tipo de respuesta, para promover su transmisiû°n al siguiente hospedero.
El mecanismo por el cual IRE1α promueve una respuesta inflamatoria sigue sin resolverse. Los autores proponen un modelo simple en el cual la estimulaciû°n de IRE1α conduce a la formaciû°n de un complejo entre TRAF2 (una ubiquitina ligasa que se une a IRE1α), NOD1 y NOD2 (fig. 1). Esto activa a RIP2, presumiblemente, mediante la interacciû°n entre estas proteûÙnas. Aunque esto es consistente con el requisito de TRAF2, ambaa proteûÙnas NOD y RIP2 para generar una respuesta inflamatoria, la interrogante de cû°mo los receptores NOD podrûÙan ser activados en ausencia de ligandos derivados de microorganismos permanece sin dilucidarse. Aunque las enzimas NOD tienen un papel en la detecciû°n de peptidoglicano, sû°lo recientemente ha surgido informaciû°n que muestra que el peptidoglicano se puede unir directamente a estas proteûÙnas. Es posible que la seûÝalizaciû°n independiente de peptidoglicano desencadenada por el estrûˋs del RE active un mecanismo bioquûÙmico distinto a travûˋs de NOD. Una alternativa es que ligandos derivados del hospedero se generen en respuesta al estrûˋs del organelo celular y sean capaces de activar los receptores NOD en el citoplasma.
A pesar de estas incertidumbres, la investigaciû°n de Keestra-Gounder y sus colegas llama a seguir indagando en este campo de forma de ampliar el conocimiento sobre el papel de las proteûÙnas NOD en la inmunidad innata mûÀs allûÀ de su rol en ô simplemente detectar ligandos bacterianos.ô Durante mucho tiempo se ha reconocido que la respuesta inmunitaria frente ô patû°genos en las plantas se basa, en parte, en el control de varios procesos fisiolû°gicos normales de la cûˋlula hospedera, y que la interrupciû°n de estos procesos por un patû°geno que desencadena la respuesta. Actualmente, es cada vez mûÀs evidente que la inmunidad innata de mamûÙferos tambiûˋn utiliza esta estrategia para proteger mû¤ltiples nodos celulares comû¤nmente perturbados por agentes patû°genos; ûˋstos incluyen la integridad traduccional de la membrana, la funciû°n mitocondrial, la homeostasis del RE y la integridad del citoesqueleto. Sorprendentemente, tanto las seûÝales de alerta del RE y del citoesqueleto se retransmiten por NOD de una manera independiente del ligando, permitiendo a estas enzimas participar en la detecciû°n de una amplia gama de patû°genos.
Esta seûÝalizaciû°n NOD independiente de ligando tambiûˋn tiene potenciales implicancias potenciales para la salud humana, mûÀs allûÀ del ûÀmbito de las enfermedades infecciosas. Varias enfermedades crû°nicas comunes, incluyendo la diabetes tipo 2 y la enfermedad inflamatoria intestinal, estûÀn asociadas al estrûˋs del retûÙculo endoplasmûÀtico y procesos inflamatorios, por lo que futuras terapias dirigidas a la regulaciû°n de esta nueva vûÙa identificada para la inflamaciû°n representarûÙan un gran avance para la medicina.ô
Fuente bibliográfica
Immunology: Organelle stress triggers inflammation
Bennett H. Penn & Jeffery S. Cox
Department of Medicine, Division of Infectious Diseases, University of California, San Francisco, San Francisco, California 94143, USA.
doi:10.1038/nature17882