El envenenamiento de las cÃĐlulas cancerÃgenas
Los tumores poseen una regulaciÃģn redox disfuncional que resulta en la producciÃģn de especies reactivas del oxÃgeno, daÃąando tanto al ADN como a nucleÃģtidos libres, los que son requeridos en forma Ãģptima para la replicaciÃģn del material genÃĐtico, asà como tambiÃĐn para su reparaciÃģn. Estudios previos han mostrado que lÃneas celulares cancerÃgenas, tras la exposiciÃģn a citidinas oxidadas, son afectadas inesperadamente conduciendo a su mortalidad. Esto, se explicarÃa por la sobreexpresiÃģn de citidina desaminasa (CDA), enzima que convierte formas oxidadas de citidinas en sus variantes de uridina, las que se incorporan al ADN, resultando en la acumulaciÃģn de daÃąo en el material genÃĐtico y muerte celular. Estas observaciones, junto con ampliar el conocimiento sobre la reparaciÃģn de nucleÃģtidos y del metabolismo de bases oxidadas y modificadas epigenÃĐticamente, sugieren una nueva opciÃģn terapÃĐutica para tratar el cÃĄncer.
NucleÃģsidos oxidados como terapia anti-cancerÃgena
La lucha contra el cÃĄncer resistente a quimioterapia sigue siendo una de las tareas mÃĄs difÃciles en clÃnica y esta batalla a menudo se pierde. Los nucleÃģsidos artificiales o anÃĄlogos de nucleobases (antimetabolitos) constituyen tratamiento de primera lÃnea contra muchos cÃĄnceres hehematolÃģgicos y ciertos cÃĄnceres sÃģlidos. Las tasas iniciales de respuesta a estas terapias suelen ser altas, pero los efectos adversos son dosis-limitantes y las alteraciones de vÃas del metabolismo de nucleÃģtidos pueden resultar en una resistencia a los medicamentos.
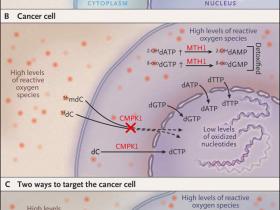
Los nucleÃģtidos, los que son derivados de nucleÃģsidos (adenosina, guanosina, citidina, timidina y uridina), son componentes clave del ARN y del ADN y son crÃticos para la supervivencia celular. Por lo tanto, el mantenimiento de un control estricto del metabolismo de estas molÃĐculas asà como la prevenciÃģn de daÃąos sobre este conjunto de nucleÃģtidos son cruciales. Si se incorporan nucleÃģsidos oxidados en el ADN, estos pueden generar estragos en la expresiÃģn gÃĐnica, causando mutaciones y daÃąo en el ADN, lo que puede ser tÃģxico para las cÃĐlulas. Las proteÃnas MTH1 evitan que purinas oxidadas (por ejemplo, 8-oxo-2'-desoxiguanosina-5'-trifosfato [8-oxo dGTP] o 2-hidroxi-2'-desoxiadenosina 5'-trifosfato [2-OH dATP], derivadas de nucleÃģsidos de guanosina y adenosina) sean incorporadas al ADN (fig. 1), pero hasta la publicaciÃģn de un reciente estudio reportado por Zauri y colaboradores (Nature 2015; 524: 114-8), se sabÃa poco acerca de cÃģmo las cÃĐlulas estÃĄn protegidas de pirimidinas oxidadas (derivadas de los nucleÃģsidos citidina, timidina y uridina). Estos investigadores encontraron que la citidina monofosfato quinasa 1 (CMK1) discrimina entre especies de citidina oxidadas, potencialmente tÃģxicas y citidinas no modificadas. La especificidad de CMPK1, por lo tanto, previene la incorporaciÃģn de nucleÃģsidos modificados de forma natural en el ADN, lo que de otra manera podrÃa obstruir el metabolismo del material genÃĐtico y causar efectos tÃģxicos (fig. 1A).
En el caso de la quimioterapia que involucra a anÃĄlogos de nucleÃģsidos artificiales, tales como citarabina, azacitidina, o gemcitabina, la enzima CMPK1 y otras quinasas no pueden discriminar entre citidina y estos anÃĄlogos. Por lo tanto, estas molÃĐculas son fosforiladas e incorporadas al ADN (y en algunos casos tambiÃĐn en al ARN), conduciendo al daÃąo del material genÃĐtico y en Última instancia, a la muerte de las cÃĐlulas cancerÃgenas.
Aunque CMPK1 actÚa como un guardiÃĄn, dado que impide la incorporaciÃģn en el ADN de especies de citidina modificadas naturalmente, Zauri y colegas descubrieron una forma de eludir esta enzima. Mediante la adiciÃģn de citidinas oxidadas y con modificaciones epigenÃĐticas (es decir, 5-hidroximetil-2'desoxicitidina [5hmdC] y 5-formil-2'desoxicitidina [5fdC]) a lÃneas celulares de cultivo, se encontrÃģ inesperadamente que algunas de esas lÃneas celulares mostraron altas tasas de mortalidad, indicando que la protecciÃģn ante esas formas oxidadas de nucleÃģsidos se habÃa perdido. Luego, los autores mostraron que las cÃĐlulas cancerÃgenas sobreexpresan citidina desaminasa, enzima que convierte 5hmdC y 5fdC en sus contrapartes con uracilo, las cuales luego son incorporadas en el ADN (fig. 1B).
Previamente, se ha reportado que la resistencia a anÃĄlogos de citidina comÚnmente usados (por ejemplo, citarabina y gemcitabina) puede ser mediada por la sobreexpresiÃģn de citidina desaminasa. Dado que las cÃĐlulas resistentes a la quimioterapia sobreexpresan esta enzima que convierte molÃĐculas de citidina a molÃĐculas de uridina (tÃģxicas cuando se incorporan en el ADN), Zauri y su equipo plantearon la hipÃģtesis de que nucleÃģsidos de citidina oxidados en altas concentraciones pueden eliminar cÃĐlulas cancerosas resistentes a la quimioterapia de una forma selectiva (CMPK1 protege a las cÃĐlulas normales de los efectos tÃģxicos de estos nucleÃģsidos. Las cÃĐlulas normales tampoco presentan altos niveles de citidina desaminasa, por lo que no se espera que puedan formar derivados tÃģxicos de uridina). Los autores trataron ratones portadores de tumores con citidinas oxidadas (5hmdC y 5fdC), encontrando una buena actividad antitumoral, la que fue selectiva para los tipos de cÃĄncer que sobreexpresan citidina deaminasa y que eran presumiblemente resistentes a la quimioterapia. No hubo efectos adversos observados en los ratones.
Este resultado eleva el espectro de un ensayo en el que 5hmdC y 5fdC sean utilizadas para tratar personas con cÃĄncer resistente a quimioterapia que sobreexpresan citidina desaminasa. La resistencia a 5hmdC y a 5fdC es probable que surja, debido a la reversiÃģn a la baja expresiÃģn de citidina desaminasa. Una mejor estrategia podrÃa ser combinar estas molÃĐculas en un tratamiento conjunto con anÃĄlogos de citidina, de forma de prevenir la resistencia. Un asunto complicado podrÃa ser que la resistencia a anÃĄlogos de citidina puedan tambiÃĐn desarrollar vÃas que no involucren la sobreexpresiÃģn de citidina desaminasa.
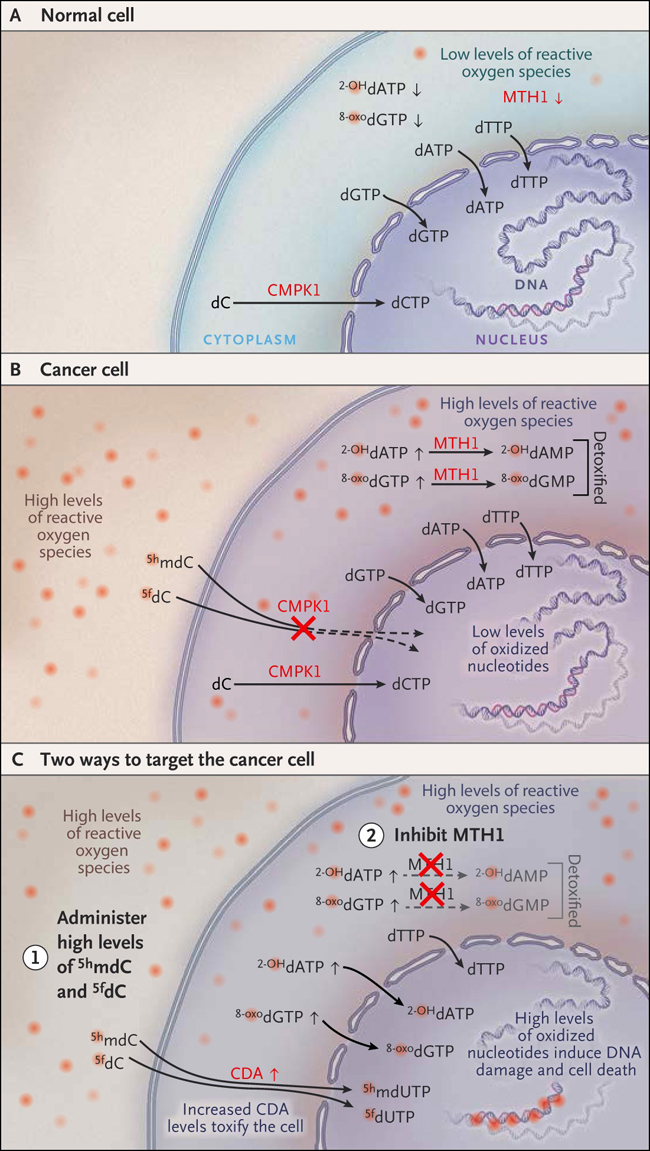
Figura 1: nucleÃģsidos oxidados como estrategia terapÃĐutica contra el cÃĄncer.
La homeostasis redox balanceada previene la acumulaciÃģn de nucleÃģtidos oxidados (por ejemplo, 8-oxo-2 'desoxiguanosina-5'-trifosfato [8-oxodGTP] o 2-hidroxi-2 'desoxiadenosina 5'-trifosfato de [2-OHdATP]) en cÃĐlulas normales, y de esta forma, la actividad de la enzima MTH1 (que desintoxica estos nucleÃģtidos oxidados, convirtiÃĐndolos en 2-OHdGMP y 2-OHdAMP) no es necesaria para la supervivencia (panel A). La citidina monofosfato quinasa 1 (CMPK1) normalmente fosforila a la desoxicitosina (dC) a su forma trifosfato (dCTP) y protege cÃĐlulas cÃĄncerÃgenas previniendo la fosforilaciÃģn de formas oxidadas de 5-metildesoxicitidina (por ejemplo, 5-hidroximetil-2'desoxicitidina [5hmdC] y 5-formil 2'desoxictidina [5fdC]) y por consecuencia, la incorporaciÃģn de estas citidinas tÃģxicas en el ADN. En las cÃĐlulas cancerosas, una homeostasis redox desregulada genera una alta carga de nucleÃģtidos oxidados. Por lo tanto, la supervivencia celular depende de la desintoxicaciÃģn de estos nucleÃģsidos mediante MTH1 y potencialmente por otras 8-oxodGTPasas (panel B). Estudios recientes (Nature 2014; 508: 215-21) sugieren dos nuevas estrategias para eliminar cÃĐlulas cancerÃgenas (panel C). La inhibiciÃģn de la actividad de MTH1 resulta en la incorporaciÃģn de nucleÃģtidos oxidados en el ADN, generando lesiones tÃģxicas. AdemÃĄs, ciertos tipos de cÃĄncer sobreexpresan citidina desaminasa (CDA), lo que los hace resistentes al tratamiento con anÃĄlogos de nucleÃģsidos. Sin embargo, CDA convierte los nucleÃģsidos oxidados 5hmdC y 5fdC en uridinas tÃģxicas, que son posteriormente fosforilados (5HmdUTP y 5FdUTP) e incorporados en el ADN de estas cÃĐlulas cancerÃgenas resistentes a la quimioterapia, induciendo la muerte celular.
Las cÃĐlulas cancerosas normalmente tienen altos niveles de especies reactivas de oxÃgeno y de nucleÃģsidos oxidados como una consecuencia de una pÃĐrdida de la regulaciÃģn redox. Por lo tanto, dependen en gran medida de MTH1 y probablemente de CMPK1 para evitar la incorporaciÃģn de nucleÃģsidos tÃģxicos en el ADN. Se ha demostrado que la inhibiciÃģn de MTH1 elimina selectivamente cÃĐlulas cancerosas por medio de la incorporaciÃģn de nucleÃģsidos oxidados en el ADN, fenÃģmeno que no ocurre en cÃĐlulas normales. El envenenamiento selectivo de estas cÃĐlulas â a travÃĐs de la inhibiciÃģn de MTH1 para aumentar el nivel de nucleÃģtidos oxidadas o con el uso de nucleÃģsidos oxidados dirigidos directamente a estas cÃĐlulas â representa una estrategia basada en el conocimiento acumulado por dÃĐcadas sobre terapias antimetabolitos.
Fuente bibliográfica
Poisoning Cancer Cells with Oxidized Nucleosides
Thomas Helleday, Ph.D.
Division of Translational Medicine and Chemical Biology, Department of Medical Biochemistry and Biophysics, Karolinska Institutet, Stockholm.
DOI: 10.1056/NEJMcibr1510335