EdiciĂłn genĂłmica para xenotrasplantes
El xenotrasplante es una estrategia prometedora para aliviar la escasez de Ăłrganos para el trasplante humano. Además de las preocupaciones sobre la compatibilidad inmunolĂłgica entre cerdos y las personas, el riesgo de transmisiĂłn de retrovirus endĂłgenos porcinos (PERV) ha impedido la aplicaciĂłn clĂnica de este enfoque. Sin embargo, nuevos estudios han mostrado la inactivaciĂłn de los PERV en una lĂnea celular de cerdo inmortalizada. Recientemente, se ha confirmado que los PERV infectan las cĂ©lulas humanas, y se ha observado transferencia horizontal de PERV entre las cĂ©lulas humanas. Utilizando CRISPR-Cas9, se logrĂł desactivar todos los PERV en una lĂnea de cĂ©lulas primarias porcinas y generar cerdos con retrovirus inactivados a travĂ©s de transferencia nuclear de cĂ©lulas somáticas. Estos avances destacan el valor de la inactivaciĂłn de los PERV para prevenir la transmisiĂłn viral y muestra la exitosa producciĂłn de animales libres de retrovirus con la finalidad de abordar la preocupaciĂłn de seguridad en el xenotrasplante clĂnico.
Retrovirus inactivados
El xenotrasplante utilizando cĂ©lulas, tejidos u Ăłrganos de cerdos puede ser la mejor manera de aliviar la creciente carga impuesta por la falta de donaciĂłn de Ăłrganos. Los cerdos son fisiolĂłgicamente similares a los humanos, son fáciles de manipular genĂ©ticamente, y tienen un gran nĂşmero de progenie y un tiempo de reproducciĂłn relativamente corto. En contraposiciĂłn a estas ventajas, los riesgos son el rechazo inmunolĂłgico de un Ăłrgano xenobiĂłtico, incompatibilidad fisiolĂłgica, y la transmisiĂłn de microorganismos porcinos. Sin embargo, el campo de xenotrasplante ha visto un considerable avance en los Ăşltimos años. Se han llevado a cabo exitosamente dos ensayos clĂnicos en los que las cĂ©lulas de los islotes de cerdo fueron trasplantadas para tratar diabetes. Afortunadamente, en estos ensayos no se evidenciĂł una transmisiĂłn de microorganismos porcinos.
No obstante, bacterias, virus y otros microorganismos tambiĂ©n podrĂan ser transmitidos por el animal donante. El análisis del viroma (la poblaciĂłn total de virus en el cerdo) ha revelado la presencia de cientos de virus. Actualmente, se sabe que despuĂ©s de un alotrasplante (trasplante de Ăłrganos de humanos a otros humanos), puede ocurrir la transmisiĂłn de patĂłgenos como el virus de inmunodeficiencia humana, citomegalovirus, e incluso el virus de la rabia. Pero, se desconoce si los virus porcinos tienen la capacidad de infectar cĂ©lulas humanas y provocar enfermedades en el receptor durante el xenotrasplante.
Sin embargo, se ha demostrado que varios virus porcinos, como el virus de la influenza, el virus de Nipah, virus Menangle y el de la hepatitis E (VHE), inducen enfermedades en humanos. Afortunadamente, los mĂ©todos establecidos pueden producir animales donantes que estĂ©n libres de la mayorĂa de los virus. Éstos incluyen transferencia de embriones, cesárea, desviaciĂłn de calostro, vacunaciĂłn, medicamentos antivirales y aislamiento. Pese a lo anterior, estas precauciones hacen poco para disminuir el riesgo de la transmisiĂłn placentaria del VHE y no tienen ningĂşn efecto en los retrovirus endĂłgenos porcinos (PERV).
Los ERV son el resultado de una infecciĂłn antigua por un retrovirus en los ovocitos o espermatozoides. Los retrovirus crean una copia de ADN de su genoma del ARN (utilizando la enzima viral transcriptasa reversa) e insertarlo en el su genoma celular en el hospedero mediante la enzima integrasa. Si esto ocurre en un Ăłvulo o espermatozoide involucrado en la generaciĂłn de progenie, el provirus, como otros genes, estarán presentes en el genoma de todas las cĂ©lulas de y puede transmitirse a sus descendientes.Â
El nĂşmero de PERV integrados en diferentes variedades de porcino van desde 3 a 140 copias, y hay pruebas de que algunos se están replicando y recombinando activamente. Los aislados virales PERV-A y PERV-B están presentes en todos los cerdos; PERV-C está presente en la mayorĂa pero no todos. Mientras que PERV-A y PERV-B son capaces de infectar las cĂ©lulas humanas, PERV-C sĂłlo puede infectar a las cĂ©lulas porcinas. Sin embargo, los recombinantes de PERV-A y PERV-C conservan la capacidad de infectar cĂ©lulas humanas y se caracterizan por una mayor tasa de replicaciĂłn que PERV-A. La Ăşnica manera de desactivar los PERV es editando el genoma. Los intentos iniciales, con el uso de una nucleasa con dedos de zinc, han sido fallidos: los cortes mĂşltiples en el genoma tenĂan un efecto citotĂłxico. Sin embargo, Yang y sus colegas (Science. 2015 Nov 27;350(6264):1101-4) usando la tecnologĂa CRISPR-Cas, lograron desactivar 62 secuencias de PERV en una lĂnea celular porcina inmortalizada. Actualmente, Niu y sus colaboradores (Science. 2017 Sep 22;357(6357):1303-1307) han tenido Ă©xito en generaro lechones vivos y sanos en los que la se han desactivado PERV de manera exitosa (figura 1).
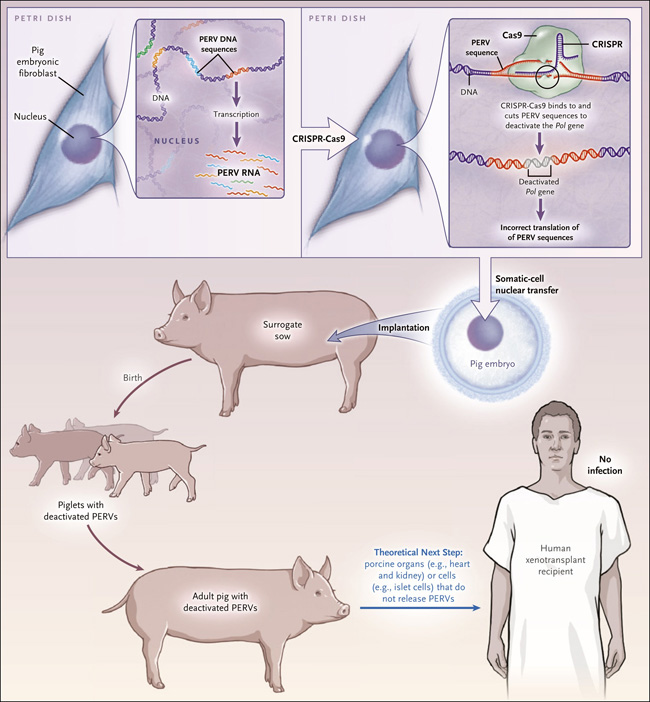
Figura 1. Hacia el Xenotrasplante - EdiciĂłn del Genoma del Cerdo.
Niu y sus colegas, recientemente reportaron la generaciĂłn de cerdos en los cuales todos los retrovirus endĂłgenos porcinos (PERV) habĂan sido inactivados. Usando un mĂ©todo llamado CRISPR-Cas, inactivaron el gen de la polimerasa viral previniendo asĂ la liberaciĂłn de virus infecciosos. Luego transfirieron los nĂşcleos de estas cĂ©lulas tratadas, hacia ovocitos de cerdo, dando lugar a embriones que luego fueron transferidos a cerdas madres de alquiler. Este proceso dio lugar al nacimiento de lechones sanos con PERV inactivados.
Los autores editaron los genomas de fibroblastos primarios fetales de cerdo que normalmente portan 25 secuencias PERV. Esto lo realizaron utilizando un complejo CRISPR-Cas que se dirige a una secuencia en el gen de la polimerasa PERV que codifica la transcriptasa reversa. Por lo tanto, se desactivaron todas las secuencias PERV. Luego se trasladaron los nĂşcleos de estas cĂ©lulas en ovocitos de cerdo enucleados (un proceso llamado clonamiento transferencia nuclear de cĂ©lulas somáticas) y se transfirieron los embriones resultantes a las cerdas sustitutas. Aunque la eficiencia de preñez fue un poco más baja que en el caso de los embriones silvestres que no habĂan sido tratados con el CRISPR-Cas, se logrĂł producir 37 lechones con PERV inactivados a partir de 17 cerdas tras el trasplante de 200 a 300 embriones por animal. Un total de 15 lechones sobrevivieron, y alcanzaron la edad de 4 meses en el momento de la publicaciĂłn.
Si el hallazgo de que los PERV pueden infectar a cĂ©lulas humanas in vitro se traduce a la infecciĂłn de seres humanos y si pueden inducir enfermedades caracterĂsticas de los retrovirus (por ejemplo, inmunodeficiencia y el cáncer), el enfoque demostrado por los equipos de Yang y Niu podrĂan reducir el riesgo de PERV tras el xenotrasplante a cero. Sin embargo, sigue habiendo obstáculos en el camino hacia el xenotrasplante como procedimiento mĂ©dico de rutina. Primero, los cerdos con PERV inactivados pueden albergar otros virus como el VHE, el citomegalovirus porcino, y circovirus porcinos, por nombrar algunos. El VHE se ha transmitido de cerdos a seres humanos y puede inducir enfermedades, y el citomegalovirus porcino se ha demostrado que disminuye sustancialmente el tiempo de supervivencia de los riñones de cerdo en primates. Segundo, serán necesarias modificaciones genĂ©ticas adicionales para ayudar a prevenir el rechazo inmunolĂłgico del trasplante, particularmente el rechazo hiperagudo que es la causa distintiva del rechazo del xenotrasplante.
Fuente bibliográfica
Paving the Path toward Porcine Organs for Transplantation
Joachim Denner, Ph.D.
Robert Koch Institute, Berlin.
DOI: 10.1056/NEJMcibr1710853