Comunicación celular: obstáculo para el deterioro muscular
Las interacciones entre las cĂ©lulas madre y su microambiente, o nicho, son esenciales para su mantenimiento y funcionalidad. Sin embargo, el conocimiento acerca del nicho de estas cĂ©lulas precursoras del mĂşsculo esquelĂ©tico, aun es incompleto. Recientes estudios muestran que una proteĂna llamada integrina β1 es una molĂ©cula crucial para mantener la homeostasis de cĂ©lulas troncales y sustenta la expansiĂłn y auto-renovaciĂłn de este grupo de cĂ©lulas durante la regeneraciĂłn. Además, se evidencia que la integrina β1 y la proteĂna de la matriz extracelular, fibronectina, están desreguladas en cĂ©lulas madre musculares envejecidas, pero al reconstituir su funciĂłn, se restaura la capacidad regenerativa del mĂşsculo. Por lo tanto, estos hallazgos representan dos nuevas potenciales dianas terapĂ©uticas para el tratamiento de enfermedades musculares.
CĂ©lulas madre musculares
El envejecimiento se asocia con un declive progresivo reflejado en la masa muscular esquelĂ©tica y en la capacidad regenerativa. Los mĂşsculos debilitados aumentan la probabilidad de lesiĂłn, y los procesos de reparaciĂłn poco eficaces propagan un cĂrculo vicioso que afecta negativamente la calidad de vida. En consecuencia, se requieren de intervenciones que sean capaces de mejorar la regeneraciĂłn del mĂşsculo envejecido. El mĂşsculo esquelĂ©tico es mantenido por cĂ©lulas madre residentes, llamadas cĂ©lulas satĂ©lites o cĂ©lulas troncales musculares (MuSC, por sus siglas en inglĂ©s), que permanecen en estado de reposo en tejidos sanos. La funciĂłn de estas cĂ©lulas se mantiene como tal hasta que exista algĂşn tipo de daño o estrĂ©s, eventos que desencadenan su activaciĂłn para la reparaciĂłn de tejidos. El nicho de cĂ©lulas madre, compuesto por tipos de cĂ©lulas de soporte, factores de crecimiento locales y molĂ©culas de matriz extracelular (MEC), es crucial para promover la auto-renovaciĂłn y diferenciaciĂłn durante la regeneraciĂłn muscular.
Recientemente, varios grupos de investigadores han identificado un deterioro progresivo en la auto-renovaciĂłn de MuSC que acompaña al envejecimiento. Se han identificado varios factores, incluyendo alteraciones en la composiciĂłn del nicho, interacciones deterioradas con elementos de nicho y transducciĂłn distorsionada a travĂ©s de cascadas relevantes de señalizaciĂłn. Colectivamente, esto disminuye el tamaño y la funciĂłn del conjunto de MuSC a travĂ©s de la pĂ©rdida de la quiescencia, diferenciaciĂłn prematura o senescencia. Sin embargo, aun no se logra una comprensiĂłn global de los cambios nocivos que afectan a las MuSC y a su nicho durante el envejecimiento.Â
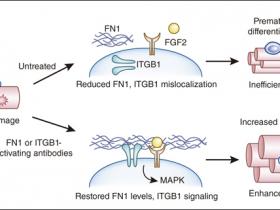
En una reciente investigaciĂłn Rozo y colaboradores (Nat Med. 2016 Aug;22(8):889-96) y Lukjanenko y su equipo (Nat Med. 2016 Aug;22(8):897-905) proporcionan evidencia, principalmente en modelos de ratĂłn, de que las interacciones de nicho de las MuSC son necesarias para el mantenimiento de su funciĂłn y para la reparaciĂłn tisular. Los autores muestran que el receptor de superficie celular integrina-β1 y la proteĂna de MEC fibronectina, están desreguladas en MuSC envejecidas, y que al reconstituir su funciĂłn, restaura la capacidad regenerativa del mĂşsculo (figura 1). Por lo tanto, los dos estudios identifican dos nuevas dianas terapĂ©uticas para el tratamiento de enfermedades musculares.
Rozo y su equipo reportaron que la actividad de la integrina β1, un sensor crucial del nicho de MuSC, se ve alterada en las MuSC envejecidas. Los autores evidenciaron que la deleciĂłn genĂ©tica condicional de esta proteĂna en ratones jĂłvenes recapitula mĂşltiples aspectos del fenotipo envejecido, incluyendo quiescencia interrumpida, proliferaciĂłn reducida y un sesgo hacia la diferenciaciĂłn que da como resultado la pĂ©rdida de MuSC y una menor regeneraciĂłn. Los autores tambiĂ©n encontraron que la deleciĂłn de integrina β1 perjudicĂł la capacidad de las MuSC para responder a las señales microambientales, como el potente mitĂłgeno FGF2. El tratamiento de las MuSC envejecidas con anticuerpos activadores de la integrina β1 restaurĂł la sensibilidad frente a FGF2 aumentando la asociaciĂłn de FGF2 con su receptor, lo que promoviĂł la proliferaciĂłn de MuSC a travĂ©s de la actividad y polarizaciĂłn de varias proteĂnas quinasas activadas por mitĂłgenos (MAP quinasas). La entrega de fibronectina mejorĂł la capacidad de respuesta de MuSC ante FGF2 en cultivo en una forma dependiente de integrina, lo que enfatiza la naturaleza cooperativa del intercambio de nicho MuSC. Además, la administraciĂłn de anticuerpos activadores de la integrina β1 en modelos de ratĂłn rescatĂł el potencial regenerativo del mĂşsculo envejecido y distrĂłfico a travĂ©s de la restauraciĂłn de la expansiĂłn de las MuSC, aumentando el tamaño de la miofibra y mejorando el rendimiento muscular.
Por otro lado, Lukjanenko y sus colegas investigaron el papel de los componentes de la MEC en MuSC envejecidas. Llevando a cabo análisis de expresión génica en MuSC de ratón maduras y jóvenes los autores determinaron que después de una lesión muscular, la fibronectina no está sobrerregulada suficientemente en los músculos de edad avanzada, lo contrario a lo observado en la musculatura jóven. La fibronectina producida por las propias MuSC ha demostrado formar un complejo con Wnt7a, una molécula de señalización secretada, y su receptor es capaz de promover su expansión simétrica durante la reparación muscular. Los autores muestran que los principales productores de fibronectina -células hematopoyéticas y endoteliales- son menos abundantes en los músculos regeneradores envejecidos.
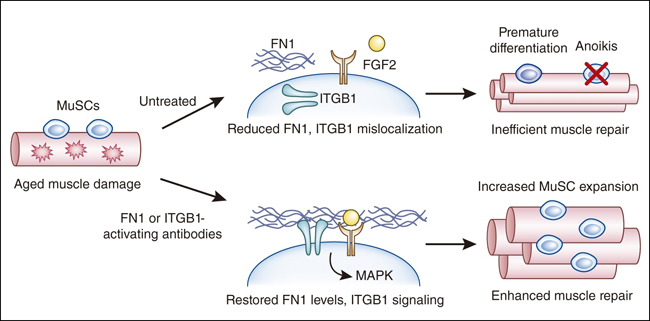
Figura 1: enfoques dirigidos a las interacciones de nicho de las MuSC, mejoran la auto-renovación y la reparación del músculo esquelético.
Recientes investigaciones en ratones envejecidos demuestran que los componentes de nicho de las MuSC como la fibronectina (FN1) e integrina β1 se pierden o se desregulan en ratones envejecidos. La restauraciĂłn de los niveles de fibronectina o de la actividad de la integrina β1 puede promover la proliferaciĂłn de las MuSC y la auto-renovaciĂłn, al tiempo que inhibe su diferenciaciĂłn prematura y anoikis (apoptosis inducida por la pĂ©rdida de anclaje de la cĂ©lula a la matriz extracelular), lo que mejora la regeneraciĂłn y el rendimiento muscular.
La deleciĂłn condicional de fibronectina en ratones jĂłvenes recapitulĂł el fenotipo de envejecimiento, lo cual redujo el nĂşmero de MuSC. Los ensayos realizados in vitro mostraron además que la fibronectina es el sustrato de adhesiĂłn preferido para los mioblastos de ratĂłn y humanos, y es capaz de modular varias vĂas de señalizaciĂłn que se alteran en las MuSC maduras, incluyendo las MAP quinasas p38 y ERK. Las MuSC envejecidas redujeron su adhesiĂłn a la fibronectina, su expresiĂłn quinasa de adhesiĂłn focal (FAK) y aumentaron los niveles de anoikis, o la muerte celular programada dependiente de la adhesiĂłn. Consistentemente, la integrina β1 se requiere para la apropiada adhesiĂłn de mioblastos humanos y de ratones a la fibronectina y para la sobreregulaciĂłn de FAK. Además, la exposiciĂłn de las MuSC maduras a fibronectina en cultivo y la inyecciĂłn de esta glicoproteĂna en los mĂşsculos viejos reprimiĂł estos defectos, aumentando el nĂşmero total de progenie de MuSC y acelerando la reparaciĂłn muscular, en comparaciĂłn con los controles tratados con vehĂculo.
Ambos estudios identifican a la integrina y fibronectina como molĂ©culas clave que se pierden o desrregulan con la edad y que son requeridas para la funciĂłn adecuada de las MuSC. La deleciĂłn de estos dos genes en ratones jĂłvenes perjudica las interacciones de nicho y la auto-renovaciĂłn de las MuSC, imitando aspectos del envejecimiento prematuro en los mĂşsculos regeneradores. La naturaleza de ambas molĂ©culas, sugiere que tanto los factores intrĂnsecos como los ambientales son parcialmente responsables de los defectos relacionados con la edad en la reparaciĂłn muscular. En un futuro, será importante explorar cĂłmo estas dos proteĂnas están reguladas en los tejidos envejecidos, lo que podrĂa permitir la identificaciĂłn de vĂas o procesos epigenĂ©ticos que impulsan el declive funcional en las MuSCs con la edad.
Además, la comprensiĂłn de cĂłmo la integrina discrimina entre diversos estĂmulos externos para iniciar las cascadas adecuadas de señalizaciĂłn podrĂa conducir a la identificaciĂłn o permitir la mejora de la especificidad de las intervenciones clĂnicamente viables que están diseñadas para modificar las interacciones de nicho de las MuSC. Los hallazgos reportados en estos dos estudios proporcionan evidencia de que el desarrollo de enfoques terapĂ©uticos dirigidos a las interacciones de nicho de las MuSC podrĂa contrarrestar defectos regenerativos relacionados con la edad. Los esfuerzos futuros orientados ad desarrollo de enfoques farmacĂ©uticos o de bioingenierĂa para entregar apropiadamente molĂ©culas que sean capaces de restaurar la comunicaciĂłn de las MuSC con su microambiente local acelerarán el desarrollo de estrategias para mejorar las condiciones del desgaste muscular.
Fuente bibliográfica
The role of muscle stem cell–niche interactions during aging
Matthew Timothy Tierney & Alessandra Sacco
School of Biomedical Sciences, Sanford Burnham Prebys Medical Discovery Institute, La Jolla, California, USA.
doi:10.1038/nm.4159