Cofactor enzimĂĄtico para potenciar la salud
A lo largo de la historia de la vida en la Tierra, ha existido un requerimiento de pequeĂąas molĂŠculas llamadas nucleĂłtidos. Largas cadenas de nucleĂłtidos forman el cĂłdigo genĂŠtico, y los nucleĂłtidos individuales transducen seĂąales o transfieren energĂa. AdemĂĄs, una forma dimĂŠrica de nucleĂłtido llamada nicotinamida adenina dinucleĂłtido (NAD+) sirve al menos para dos funciones celulares pivotales. La primera es transportar electrones de alta energĂa a complejos enzimĂĄticos que se encuentran en las mitocondrias, donde su energĂa puede ser cosechada eficientemente. La segunda funciĂłn, es actuar como un sustrato para enzimas como las sirtuinas, que regulan muchos comportamientos celulares. En un reciente estudio se explica un mecanismo fundamental por el cual se mantienen niveles adecuados de NAD+ en la cĂŠlula, y se demuestra cĂłmo el aumento de esta vĂa puede modular las enfermedades.
SĂntesis de NAD+
La reserva disponible de NAD+ en una cĂŠlula se rige por el equilibrio entre su generaciĂłn y su consumo. La vĂa predominante por la cual se genera NAD+ en roedores depende del reciclaje de una molĂŠcula llamada nicotinamida (Nam) que es ingerida o liberada por enzimas que consumen NAD+ (figura 1). Existen varias otras rutas de producciĂłn de NAD+, incluyendo una vĂa de sĂntesis de novo que comienza con el aminoĂĄcido esencial triptĂłfano (Trp). Las mutaciones que interrumpen las enzimas responsables de la conversiĂłn de Trp en NAD+ provocan alteraciones del desarrollo multisistĂŠmico en humanos, lo que demuestra la importancia de esta vĂa.
Katsyuba y sus colegas (DOI: 10.1038/s41586-018-0645-6 (2018)) se propusieron estudiar el Îą-amino-β-carboximuconate-Îľ-semialdehĂdo (ACMS), un intermediario inestable y poco estudiado de la vĂa Trp. ACMS puede convertirse espontĂĄneamente al siguiente intermediario en el camino hacia NAD+, o puede ser degradado por un conjunto de enzimas, comenzando con ACMS decarboxilasa (ACMSD). Como tal, se predecirĂa que ACMSD limitarĂa la cantidad de NAD+ producido a travĂŠs de la sĂntesis de novo. ACMSD es evolutivamente conservada desde el gusano nematodo C. elegans hasta los ratones - una observaciĂłn que llama la atenciĂłn porque, hasta hace poco, no se pensaba que los nematodos sintetizaran NAD+ de novo.
Los investigadores inhibieron el gen acsd-1, que codifica el equivalente de ACMSD en nematodos. Esta inhibiciĂłn aumentĂł los niveles de NAD+. Se sabe que el aumento de NAD+ prolonga la vida de los gusanos, y los autores encontraron que la vida era mayor en los gusanos en los que la expresiĂłn de acsd-1 estaba completamente bloqueada. AdemĂĄs, la prevenciĂłn de la expresiĂłn de acsd-1 dio lugar a respuestas moleculares relacionadas con una menor progresiĂłn del envejecimiento; mejor funciĂłn mitocondrial; y una respuesta protectora al estrĂŠs de este organelo.
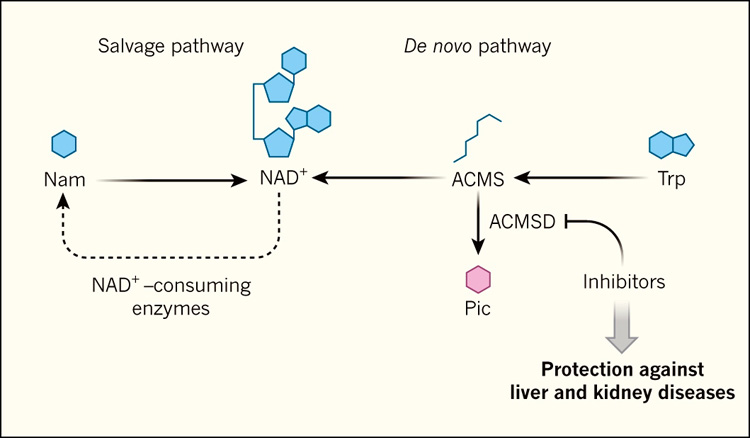
Figura 1. NAD+: biosĂntesis en la enfermedad.
Cuando las enzimas consumen la coenzima nicotinamida adenina dinucleĂłtido (NAD+), la nicotinamida (Nam) se genera como producto de reacciĂłn. A travĂŠs de un mecanismo de reciclaje llamado vĂa de salvamento, el NAD+ puede ser regenerado. El salvamento de Nam se considera el mecanismo predominante para la biosĂntesis de NAD+, pero NAD+ tambiĂŠn puede generarse a travĂŠs de mĂşltiples rutas. Una de ellas es la vĂa de novo, por la cual el aminoĂĄcido triptĂłfano (Trp) se convierte a NAD+ a travĂŠs de varios intermediarios, incluyendo Îą-amino-β-carboximuconato-Îľ-semialdehĂdo (ACMS). Esta vĂa puede ser agotada por la enzima ACMS decarboxilasa (ACMSD), que degrada el ACMS a ĂĄcido picolĂnico (Pic). Katsyuba y colaboradores (DOI: 10.1038/s41586-018-0645-6 (2018)) reportaron que la inhibiciĂłn quĂmica de ACMSD aumenta los niveles de NAD+ en ratones y gusanos nematodos, y mejora los resultados en modelos de ratĂłn de enfermedades hepĂĄticas y renales.
En ratones y humanos, la ACMSD se expresa con mayor fuerza en hĂgado y riùón, y un estudio reciente indica que estos son los principales Ăłrganos de la sĂntesis NAD+ dependiente de Trp8. Katsyuba y sus colegas encontraron que la inhibiciĂłn del gen Acmsd aumenta los niveles de NAD+ y la funciĂłn mitocondrial en cĂŠlulas de cultivo provenientes de hĂgado de ratĂłn. Por lo tanto, los autores desarrollaron inhibidores quĂmicos de ACMSD y probaron si podĂan mejorar los resultados en modelos de ratĂłn de dos enfermedades relacionadas con el envejecimiento: el hĂgado graso inducida por la dieta y la insuficiencia renal aguda.
Trabajos previos ya habĂan descrito un efecto beneficioso de aumentar NAD+ en cada uno de estos contextos. Los datos de Katsyuba y sus colegas confirmaron el potencial para el aumento terapĂŠutico de NAD+. Los tratamientos con sus inhibidores protegieron contra la enfermedad en estos modelos. Los resultados tambiĂŠn sugieren que los aumentos en la vĂa de sĂntesis de novo NAD+ por sĂ solos son lo suficientemente robustos como para mejorar las enfermedades hepĂĄticas y renales asociadas con niveles bajos de NAD+. Sin embargo, para demostrarlo serĂĄ necesario probar que el beneficio de la inhibiciĂłn de la ACMSD se deriva del aumento de NAD+, y no de otro mecanismo como el agotamiento de la molĂŠcula de ĂĄcido picolĂnico, que se produce por la degradaciĂłn de la ACMSD mediada por la misma ACMSD. Si se probara, este hallazgo serĂa consistente con un estudio que identificĂł una enzima diferente en la vĂa Trp, la quinolinato fosforibosiltransferasa, como un determinante de la susceptibilidad a la insuficiencia renal aguda.
Los inhibidores ACMSD desarrollados por Katsyuba y sus colegas son indicativos del interĂŠs en aprovechar el aumento de NAD+ en la clĂnica. Han pasado casi 20 aĂąos desde que se propuso por primera vez que NAD+ fuera un factor determinante para la esperanza de vida. Pero debido a que el envejecimiento es complejo, no se ha encontrado una definiciĂłn clĂnicamente comprobable. Los ensayos para examinar la relaciĂłn entre el aumento de NAD+ y la duraciĂłn de la vida llevarĂa demasiado tiempo para ser financieramente viables. Si, en cambio, una definiciĂłn del envejecimiento incorporara una menor resistencia a los factores estresantes agudos como las infecciones, los traumatismos o la cirugĂa, entonces las pruebas clĂnicas de los moduladores de NAD+ podrĂan ser mĂĄs viables.
Fuente bibliográfica
A back door to improved health
Samir M. Parikh
Center for Vascular Biology, Department of Medicine and Division of Nephrology, Beth Israel Deaconess Medical Center and Harvard Medical School, Boston, Massachusetts 02215, USA.
DOI: 10.1038/d41586-018-07088-4