Cáncer cerebral: un eficaz mecanismo de resistencia
Recientes estudios han logrado determinar que en ciertos tumores cerebrales, se forman estructuras denominadas microtubos, proyecciones citoplasmáticas celulares compuestas de uniones comunicantes tipo gap ricas en conexinas. Utilizando microscopía in vivo, se ha observado que células de gliomas derivadas de pacientes tienen la capacidad de extenderse ampliamente a través de estas estructuras. Estas uniones además permiten que las células tumorales colaboren con sus vecinas mediante la distribución de moléculas tóxicas y la propagación de iones calcio, siendo capaces incluso de formar nuevos núcleos para dar origen a otras células tumorales. De esta forma, actuando como una sola unidad, pueden invadir tejidos sanos del cerebro y resistir la radioterapia. El conocimiento del mecanismo que explica la capacidad invasiva de esta patología, permitirá identificar nuevas dianas terapéuticas, como por ejemplo proteínas que conforman los microtubos, de forma de atenuar la comunicación de la red tumoral.
Conectividad tumoral
Casi ningún diagnóstico es tan angustiante como el de un tumor cerebral primario. Estos, a menudo conocidos como gliomas, son un grupo variado y originado a partir células troncales inmaduras o de células gliales, que apoyan y protegen las redes neuronales a lo largo del cerebro. Los gliomas proliferan sin control, destruyendo el tejido cerebral circundante y causando un profundo daño neurológico. Además, son responsables de alrededor de 14.000 muertes anuales en los Estados Unidos y son casi siempre letales debido a su resistencia a la radioterapia y por su capacidad de infiltración en tejido cerebral sano. A pesar de estos negativos pronósticos, en un reciente artículo, Osswald y colaboradores (Nature http://dx.doi.org/10.1038/nature16071 (2015)) proyectan luz al explicar los mecanismos que confieren tales habilidades destructivas.
Los gliomas han frustrado por un buen tiempo a neurocirujanos, dado que las células cancerosas invaden el cerebro antes de que sea posible un diagnóstico, volviendo ineficiente la extirpación quirúrgica. Los tumores se mueven en el cerebro a través de espacios extracelulares, a menudo siguiendo la parte exterior de vasos sanguíneos o tractos nerviosos - en contraste con la mayoría de otros tipos de cáncer, los que difunden a través de la sangre o sistemas linfáticos. Las células invasoras deben ser eliminadas para que el tratamiento pueda tener éxito, por lo que los pacientes suelen someterse a una radioterapia agresiva en combinación con quimioterapia.
Muchos gliomas, incluyendo las variedades más malignas, resisten tanto la radiación como la quimioterapia. Sin embargo, un pequeño subgrupo llamado oligodendrogliomas, que albergan deleciones en dos regiones cromosómicas, 1p y 19q, responden bien al tratamiento con radiación y tienen un pronóstico más favorable. En consecuencia, los investigadores intentaron determinar a que se debía esa diferencia en la sensibilidad a la radiación.
Los autores marcaron células de gliomas derivadas de pacientes, las que fueron recolectadas de una variedad de tumores, antes trasplantarlas en el cerebro de ratones. Usando microscopía in vivo, visualizaron el crecimiento tumoral y la invasión hasta un año a través de una ventana implantada en la cabeza de los animales. La invasión de células del glioma que carecían de la co-deleción 1p y 19q, se extendió ampliamente a través de estructuras delgadas y contráctiles en los alrededores del tejido cerebral. Los investigadores llamaron estas estructuras microtubos tumorales.
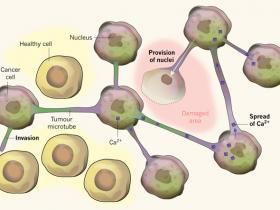
Los microtubos son ricos en proteínas actina y miosina, las que son conocidas por propulsar conos de crecimiento neuronal (estructuras en las puntas de las neuronas en desarrollo que se proyectan hacia fuera para buscar otras células para conectarse). Algunos microtubos exploran, y eventualmente invaden el cerebro sano. Por el contrario, otras células tumorales vecinas que son contactadas, forman puentes citoplasmáticos entre células adyacentes (fig. 1). Esto resulta en una efectiva conversión de estas células en una sola unidad organizacional (sincitio). Las conexiones entre microtubos de cada célula tumoral se forman por poros citoplasmáticos llenos de las denominadas uniones gap, compuestas de proteínas hexaméricas Cx43.
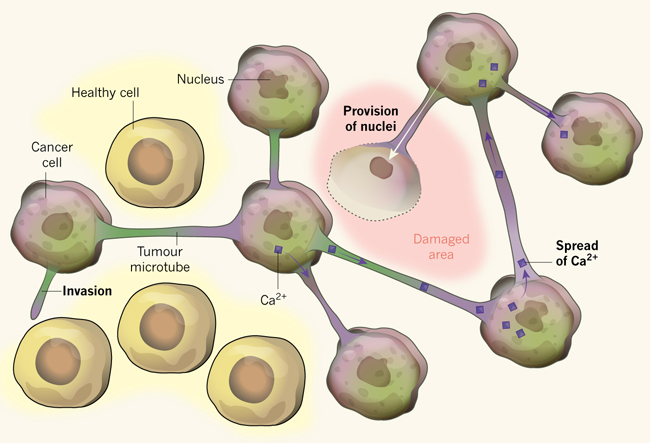
Figura 1: Una red de vecinos.
Osswald y colegas reportaron que, en algunos tipos de tumores cerebrales, estructuras llamadas microtubos conectan las células tumorales, lo que les permite actuar como una sola unidad. Los microtubos tumorales facilitan la invasión en el tejido cerebral sano. Además promueven la propagación de moléculas tóxicas tales como iones de calcio (Ca2+) que se acumulan durante la radioterapia, lo que permite a toda la unidad poder compartir la carga de la toxicidad. Por otra parte, si se realiza una excisión quirúrgica del tejido tumoral, núcleos sintetizados de novo son donados por células tumorales y estos pueden viajar por el microtubo hacia el sitio libre de células para formar nuevas células tumorales.
¿Qué ventaja podría obtener el tumor con un crecimiento similar a una sola unidad? Los investigadores hallaron que las células del sincitio son altamente resistentes a la terapia de radiación. En células no conectadas, la radiación causa un aumento de los niveles de iones calcio intracelular generando la muerte celular. Pero en células del sincitio, los niveles de Ca2+ se mantienen más estables, presumiblemente porque se distribuye entre todas las células. Además, cuando se elimina el núcleo de una célula conectada mediante láser, la célula vecina extiende un microtubo en el tejido afectado para entregar un nuevo núcleo, sustituyendo así a su vecina muerta por una célula con un núcleo recién sintetizado - lo cual representa una notable hazaña. Por lo tanto, las células conectadas pueden ser consideradas como un grupo de vigilancia, protegiéndose entre sí y compartiendo exposiciones tóxicas e incluso reemplazando a sus células vecinas con una parte de sí mismas.
Estos resultados indican que aquellos gliomas sensibles a la radiación no deberían ser parte del grupo protector. De hecho, cuando los investigadores analizaron biopsias humanas desde oligodendrogliomas, menos del 1% contenía microtubos y la expresión de Cx43 se mantuvo casi ausente. Los autores también encontraron una carencia de microtubos y de la proteína en ratones, cuando se transplantaban células derivadas del oligodendroglioma portadoras de la co-deleción 1p y 19q.
Debido a que los microtubos están en el corazón de la red del glioma, los autores buscaron genes que pudiesen regular su formación. A través del análisis computacional Ingenuity Pathway Analysis (un método para detectar genes relacionados a rasgos biológicos) identificaron a gap-43 como candidato. La proteína codificada por este gen, GAP-43, ayuda a la migración neuronal y a la formación de los conos de crecimiento neural durante el desarrollo. Se expresa de forma prominente en microtubos tumorales invasivos, sin embargo se encuentra ausente en tumores que presentan la co-deleción cromosómica. Además, la expresión forzada de GAP-43 en trasplantes derivados de oligodendrogliomas produce tumores altamente invasivos que actúan en las redes protectoras de microtubos y que resisten la radiación. De esta forma, GAP-43 parece mediar la formación tumor-microtubo.
Este estudio cuidadosamente ejecutado permite un avance en la comprensión del crecimiento de tumores cerebrales. Por ejemplo, ahora está claro que las uniones gap formadas por Cx43 son fundamentales para el éxito de las agrupaciones del glioma. Previamente, se pensaba que esta proteína actuaba como un supresor de tumores, impidiendo la división celular en el cáncer, incluyendo los gliomas. Por el contrario, los resultados implican que el crecimiento tumoral se ve favorecido por la presencia de Cx43. Esta diferencia puede conciliarse si se considera crecimiento tipo-organismo del sincitio - en este escenario, las células conectadas protegen y dan apoyo a las otras, aumentando la masa tumoral incluso cuando se expone a la radiación.
Aunque los autores plantean la hipótesis de que la distribución de Ca2+ confiere resistencia a la radiación, muchos otros mecanismos podrían estar en juego. Las uniones tipo gap permiten el traspaso de muchas macromoléculas entre las células, incluyendo ATP, aminoácidos e incluso micro ARN. Una molécula que merece atención es el antioxidante glutatión, el que penetra fácilmente las uniones comunicantes para proteger a las células del daño de la radiación.
Desde una perspectiva terapéutica, Cx43 es una diana farmacológica interesante. Esta proteína se expresa en todo el organismo y es necesaria tanto para el transporte de metabolitos celulares, señales y productos de desecho a través de la glía, y para asegurar que las células cardíacas se contraigan sincronizadamente. Los fármacos que bloquean Cx43 han sido utilizados para curar úlceras cutáneas crónicas en humanos y para mejorar la eficacia quimioterapéutica del fármaco temozolamida en el tratamiento de gliomas en ratones. Sin embargo, el descubrimiento de Osswald y colegas referido a que GAP-43 es responsable del establecimiento de redes del glioma, puede apuntar a un objetivo más eficaz para combatir estos destructivos tipos de cáncer.
Fuente bibliográfica
Brain cancer: Tumour cells on neighbourhood watch
Harald Sontheimer
Virginia Tech Carilion Research Institute, Glial Biology in Health, Disease & Cancer Center, Roanoke, Virginia 24016, USA.
doi:10.1038/nature15649