Ataque sobre péptidos amiloides para el alzhéimer
El alzhĂ©imer se caracteriza por la deposiciĂłn de placas beta amiloides (AĂź) y de ovillos neurofibrilares en el cerebro, que originan disfunciĂłn neuronal y sináptica. Dentro de las estrategias para combatir esta patologĂa se encuentra la inmunoterapia, metodologĂa basada en anticuerpos contra estas estructuras. Este enfoque si bien facilita la eliminaciĂłn de estas acumulaciones proteicas no ha podido solucionar totalmente el grave deterioro cognitivo que sufren los pacientes afectados por esta enfermedad. Recientes estudios han mostrado que la generaciĂłn de aducanumab, un anticuerpo monoclonal humano que se dirige selectivamente a los agregados AĂź, logra reducir la formaciĂłn de placas AĂź solubles e insolubles de una manera dosis dependiente. Además, en pacientes con alzhĂ©imer leve, la administraciĂłn intravenosa del anticuerpo disminuye la cantidad de estas estructuras, lo cual se tradujo en una menor progresiĂłn de deterioro. Estos hallazgos representan un gran progreso para comprender el mecanismo implicado en esta importante patologĂa neurodegenerativa y otorga resultados clave para avanzar en su tratamiento.
Placas amiloides
Han pasado 25 años desde que la proteĂna beta amiloide (Aβ) se propuso como causante de una cascada de eventos cerebrales que conducen a la enfermedad de Alzheimer (EA). A la fecha, se han desarrollado un nĂşmero creciente de tratamientos anti Aβ para hacer frenar esta cascada  y muchos de ellos han sido evaluados en personas que ya han desarrollado o están en riesgo de desarrollar sĂntomas de la patologĂa. En un reciente estudio Jeff Sevigny y colaboradores (doi:10.1038/nature19323) reportaron hallazgos sobre un ensayo clĂnico controlado por placebo de 12 meses de duraciĂłn en el que se utilizĂł el anticuerpo monoclonal aducanumab, el que se une selectivamente a los agregados Aβ solubles e insolubles, denominados respectivamente, oligomeros Aβ y fibrillas.
El ensayo tuvo como objetivo primario clarificar los efectos reductores de las fibrillas Aβ y la seguridad de diferentes dosis de aducanumab administradas una vez al mes por vĂa intravenosa. El estudio incluyĂł personas que habĂan sido diagnosticadas con deterioro cognitivo leve (sin tener problemas mayores de memoria ni de razonamiento) o demencia leve (con un efecto ligeramente incapacitante) debido a la EA. Cada participante tambiĂ©n era positivo para la presencia de Aβ, lo cual se evaluĂł con tomografĂa de emisiĂłn de positrones (TEM), Indicando una acumulaciĂłn moderada a frecuente de placas que contienen fibrillas, caracterĂstica fundamental de la patologĂa. Lo que no evaluĂł el estudio fue el efecto de aducanumab sobre el deterioro cognitivo.
El tratamiento se vinculĂł con una sorprendente reducciĂłn de la generaciĂłn de placas Aβ medidas por TEM de la, fenĂłmeno que fue dependiente de la dosis. Posiblemente, los autores indicaron que aducanumab tambiĂ©n era capaz de unirse y remover oligomeros Aβ de difĂcil detecciĂłn, los que se acumulan aparentemente cerca de placas y que pueden ser más dañinos que los agragados proteicos. A pesar de la relativamente baja cantidad de pacientes evaluados, los análisis exploratorios sugieren que dosis elevadas del anticuerpo y las reducciones de placas se asocian con un deterioro cognitivo más lento. Si estos hallazgos preliminares son confirmados en ensayos clĂnicos más amplios, se podrĂa proveer gran informaciĂłn acerca de la etiologĂa del alzhĂ©imer y un gran respaldo a la hipĂłtesis amiloide.
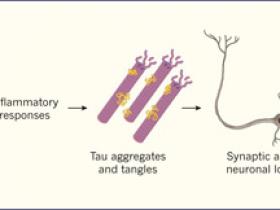
La hipĂłtesis amiloide sostiene que una forma peptĂdica de 42 aminoácidos (Aβ42) se vuelve perjudicial cuando, debido a su sobre producciĂłn o escasa remociĂłn desde el cerebro, monĂłmeros Aβ42 se acumulan en varias conformaciones, formando oligĂłmeros y fibrillas. Estos agregados gatillan una cascada de eventos neurobiolĂłgicos, que incluyen respuestas inflamatorias, agregaciĂłn, fosforilaciĂłn y propagaciĂłn de la proteĂna tau, entre otros cambios a nivel neuronal. Estos eventos contribuyen a la formaciĂłn de placas Aβ, al entrecruzamiento de proteĂnas tau, pĂ©rdida de neuronas y conexiones sinápticas entre ellas, deterioro cognitivo y otras caracterĂsticas de la EA (figura 1).
La confirmaciĂłn de la hipĂłtesis amiloide requerirá de pruebas definitivas que muestren que el tratamiento anti Aβ sea eficaz en la reducciĂłn del deterioro cognitivo en personas afectadas o en riesgo de desarrollar alzhĂ©imer. El estudio liderado por Sevigny provee evidencia de que  aducanumab puede ingresar al cerebro, dirigirse a las fibrillas de amiloides y revertir sustancialmente la deposiciĂłn de placas, lo cual representa un gran avance. Sin embargo, aunque los hallazgos son alentadores, no son definitivos.Â
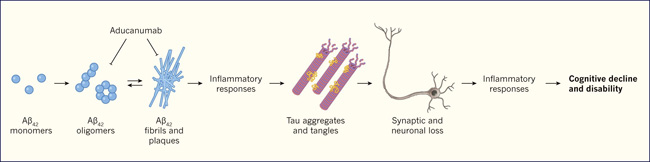
Figura 1: la hipĂłtesis amiloide.
Esta hipĂłtesis sostiene que el incremento de los pĂ©ptidos amiloides β 42 (Aβ42) gatilla una cascada de eventos en el cerebro, los que conducen a la enfermedad de Akzheimer. Bajo este postulado, monĂłmeros de Aβ42 forman agregados oligomĂ©ricos y fibrillas dañinas cerca de las placas amiloides. Estos agregados pueden desencadenar respuestas inflamatorias. Por medio de mecanismos aĂşn desconocidos, esos eventos pueden causar la agregaciĂłn, fosforilaciĂłn y propagaciĂłn de tau, una proteĂna asociada a microtĂşbulos (rosado y pĂşrpura) y que dificulta el transporte axonal debido a la formaciĂłn de ovillos neurofibrilares. Las neuronas afectadas y la sinapsis se vuelven disfuncionales, pudiendo causar la muerte celular, junto con respuestas inflamatorias adicionales. La pĂ©rdida funcional progresiva se vincula con deterioro cognitivo, otro de los sĂntomas del alzhĂ©imer. Jeff Sevigny y colaboradores muestran que aducanumab se une y promueve la remociĂłn de bloques de acumulaciĂłn de fibrillas y oligomeros.
A la fecha ya se han iniciado varios ensayos clĂnicos basados en tratamientos anti–Aβ y aĂşn más están en camino. Debido a que la generaciĂłn de Aβ puede comenzar más de dos dĂ©cadas antes del inicio de los problemas de razonamiento y de memoria, un fármaco como aducanumab que es capaz de revertir la deposiciĂłn existente, podrĂa aumentar las oportunidades de extinguir la patologĂa incluso despuĂ©s de su establecimiento.Â
La selectividad inusualmente alta de aducanumab  por fibrillas Aβ42 y oligĂłmeros,  minimiza el nĂşmero de molĂ©culas de anticuerpo que se unen a los abundantes monĂłmeros de Aβ en la sangre y, por lo tanto, maximiza el nĂşmero de anticuerpos no unidos que puede entrar al cerebro. Además, es inusualmente afĂn por las fibrillas y oligĂłmeros Aβ42 y el mecanismo por el cual recluta a la microglia, principales cĂ©lulas inmunitarias del cerebro, permite la fagocitosis y remociĂłn de fibrillas Aβ.
Por otro lado, la actividad de la microglĂa da cuenta de la capacidad del anticuerpo de remover placas, más que solo enlentecer la acumulaciĂłn de pĂ©ptidos Aβ. Por otro lado, la actividad puede incrementar la probabilidad de que personas desarrollen anormalidad de imágenes amiloides (ARIA), defecto caracterizado por la acumulaciĂłn de fluido cerebral utilizando escáner de resonancia magnĂ©tica. Como otros tratamientos con anticuerpos anti-Aβ, el estudio de Sevigny y sus colegas encontraron que aducanumab causaba con mayor tendencia ARIA en dosis más altas y en las personas portadoras del gen APOE tipo 4, principal factor de riesgo genĂ©tico para la EA.
Los autores observaron que las ARIA a veces se asociaban con dolores de cabeza transitorios, perturbaciones visuales o confusiĂłn, pero a menudo no se relacionaba con ningĂşn sĂntoma, los que además pasaban dentro de uno a tres meses. No obstante, la frecuencia de ARIA indicĂł a los investigadores el nĂşmero máximo de dosis. Por lo tanto el desafĂo será establecer una dosis que sea lo suficientemente segura y bien tolerado, pero tambiĂ©n eficaz.
Además de confirmar la hipĂłtesis amiloide, la constataciĂłn de beneficios cognitivos con aducanumab o de otros enfoques biolĂłgicos podrĂa ayudar a acelerar la evaluaciĂłn y aprobaciĂłn reguladora de terapias preventivas del alzhĂ©imer. De hecho, la confirmaciĂłn de que un tratamiento anti-Aβ ralentiza el declive cognitivo serĂa un gran avance para entender y prevenir la enfermedad de Alzheimer. El tiempo de averiguarlo es ahora.
Fuente bibliográfica
Alzheimer's disease: Attack on amyloid-β protein
Eric M. Reiman
Banner Alzheimer’s Institute, Phoenix, Arizona 85006 USA.
doi: 10.1038/537036a
Temas Relacionados