A la caza de la leucemia mieloide
Estudios previos sobre el cáncer, sugieren que su mantención puede establecerse por un número pequeño de células madre tumorales, que al no ser erradicadas conducen al fracaso de las terapias. Un caso particular es la leucemia mieloide crónica (LMC), trastorno mieloproliferativo resultante de la función anormal de la actividad tirosina quinasa de la oncoproteína BCR-ABL, producto de una translocación cromosómica. Recientes investigaciones, han mostrado que las células madre leucémicas residuales pueden ser eliminadas paulatinamente por tiazolidinedionas, fármacos antidiabéticos agonistas de receptor-gamma activado por proliferadores de peroxisomas (PPAR-γ). Al administrar este medicamento en conjunto con imatinib, un inhibidor de tirosinas quinasas, se obtuvo una respuesta sostenida hasta 4,7 años. Con lo anterior, se altera la quiescencia responsable de la mantención y troncalidad de las células leucémicas. Estos hallazgos pueden permitir la erradicación de este cáncer mediante la terapia combinada dirigida a las células troncales, reflejando un gran avance clínico para combatir esta patología.
Inhibidores moleculares
La leucemia mieloide crónica (LMC) es una enfermedad mieloproliferativa que se produce por una translocación entre los cromosomas 9 y 22 en células madre hematopoyéticas. Esta alteración, resulta en una fusión del gen ABL del cromosoma 9 y el gen BCR del cromosoma 22 formando un secuencia de ADN que codifica para la oncoproteína BCR-ABL, enzima tirosina quinasa constitutivamente activa que promueve una mielopoyesis incontrolada. La mayoría de los pacientes se presentan en una fase crónica (que dura 5 a 6 años, en promedio), con un elevado número de linfocitos circulantes, seguido por una fase acelerada en la que, sin tratamiento, progresa a crisis blásticas terminales.
Inhibidores de tirosina quinasas diseñados para tratar la actividad BCR-ABL han tenido un profundo efecto en el manejo de la LMC: con la terapia continua, usualmente se evita la progresión a la fase aguda y a la crisis blástica. Las tasas de supervivencia entre pacientes que reciben estos agentes son similares a las de los controles (emparejados por edad y sin la condición). Sin embargo, incluso con inhibidores de la tirosina quinasa, se ha visto que un reservorio de células madre quiescentes parecen persistir, y por lo tanto, menos del 10% de las personas que toman estos inhibidores tienen una respuesta molecular completa, definida como la desaparición de la expresión de BCR-ABL en las células sanguíneas. En consecuencia, por lo general se continúa con el tratamiento indefinidamente. Stéphane Prost y colegas (Nature. 2015 Sep 17;525(7569):380-3) han descrito recientemente una estrategia para eliminar las células madre leucémicas, a través del uso combinado de un inhibidor de tirosina quinasa (imatinib) y tiazolidinedionas, una clase de medicamentos usado para bajar los niveles de glucosa sanguínea, disminuyendo la resistencia a la insulina en personas con diabetes tipo 2. Las tiazolidinedionas son agonistas del receptor gamma activado por proliferadores de peroxisomas (PPAR-γ), un receptor nuclear que es a veces llamado receptor de glitazona.
Mediante el trabajo con células de cultivo CD34+ (marcador de células madre sanguíneas) aisladas a partir de una cohorte de 29 pacientes con LMC en fase crónica, Prost y colaboradores encontraron que imatinib por sí solo eliminaba células en división, pero no células quiescentes (células viables que, o bien no se dividen en absoluto o lo hacen una sola vez). Por el contrario, las células CD34+ no tratadas, proliferaron y se diferenciaron activamente en cultivo. La exposición a tiazolidinedionas de células que no se dividen, por otra parte, causó su depleción, mientras que la exposición a ambos fármacos condujo a la eliminación de las células que se dividían como las que no lo realizaban.
Sobre la base de su observación anterior, donde las tiazolidinedionas perjudicaban la hematopoyesis mediante la activación de la vía de señalización de PPAR-γ-STAT5, los investigadores analizaron minuciosamente esta vía en la LMC. La activación de la proteína STAT5 ocurre a través de su fosforilación por parte de BCR-ABL, lo cual es crítico para el mantenimiento de células madre hematopoyéticas normales y leucémicas. La exposición de células leucémicas a imatinib disminuye rápidamente la fosforilación de STAT5 mediada por BCR-ABL a un nivel que hace que las células sean susceptibles a la apoptosis. Sabiendo que PPAR-γ reprime la transcripción de STAT5 y que los niveles de expresión de esta última son anormalmente altos en células bajo una LMC, los autores trataron las células con pioglitazona, que es la tiazolidinediona más comúnmente utilizada para tratar la diabetes de tipo 2, realizado en en presencia y ausencia de imatinib.
Los investigadores observaron que la pioglitazona disminuyó rápidamente los niveles de ARN mensajero de STAT5, cercano a un 90%, y por lo tanto los niveles de la proteína también se redujeron sustancialmente. En células resistentes a imatinib, se observó una mayor expresión de proteínas diana de STAT5, río abajo en la cáscada de señalización (HIF2A y CITED2) manteniéndose el estado de reposo de las células madre, un hallazgo de relevancia debido a que pacientes que reciben imatinib rara vez tienen una respuesta molecular completa. El efecto de este medicamento sobre la expresión de genes relacionados a la troncalidad (“stemness") fue contrarrestado por la exposición simultánea a la pioglitazona (fig.1). Los autores no especificaron si las células de los individuos fuesen insensibles al imatinib o tiazolidinedionas o a su efecto combinado, dejando la interrogante relacionada a la similitud de respuestas por parte de todas las células de los pacientes y si existían personas que no tuvieron respuesta al tratamiento. Por otro lado, una fortaleza del estudio fue el uso de células primarias de pacientes con LMC, en lugar de líneas celulares leucémicas o células primarias derivadas de ratón.
El equipo de Prost administró pioglitazona durante períodos de tiempo variables, a 3 pacientes con LMC (2 de ellos diabéticos) que recibieron imatinab durante aproximadamente 5 años sin mostrar una respuesta molecular completa. Con lo anterior se logró un estado libre de enfermedad duradero dentro de 6 a 12 meses. Los autores participaron de un estudio no aleatorizado con pioglitazona en pacientes con LMC, los que recibieron tratamiento con imatinib, pero no obtuvieron una respuesta molecular completa. Los resultados provisionales de 24 pacientes mostraron un progreso y respuesta molecular del 57% dentro de los 12 meses después de la inicio del tratamiento concomitante, en comparación con el 27% en un grupo de control histórico que solo recibía imatinib. Algunos pacientes tuvieron eventos adversos conocidos para las tiazolidinedionas: aumento de peso y retención de líquidos.
El Instituto Nacional del Cáncer estima que a finales de 2014 había aproximadamente 40.000 personas en Estados Unidos con LMC. La mayoría de estos, son mayores de 65 años de edad y toman varios medicamentos además de inhibidores de tirosina quinasa. Entonces, surge la interrogante siguiente: ¿Puede una tiazolidinediona ser añadida a la terapia inhibitoria de la tirosina quinasa para curar la LMC? Para empezar, al menos una cuarta parte (unas 10.000 personas) se espera que tenga diabetes y por lo tanto que sean potenciales candidatos para tiazolidinedionas, y por otro lado inhibidores de tirosina quinasa pueden tener efectos glucometabólicos secundarios, para lo cual las tiazolidinedionas pueden ser beneficiosas. Con solo los defectos de las células beta en la secreción de insulina, sin resistencia insulínica, se excluiría inmediatamente a algunos pacientes, al igual que quienes tengan historial de insuficiencia cardíaca congestiva. Estas personas necesitarían evaluar su riesgo relacionado a la retención de líquidos (un efecto secundario conocido de ambos fármacos) y su estatus renal y cardiovascular. Por otra parte, el tratamiento se asocia a un mayor peligro de fractura ósea. La combinación puede tener efectos sinérgicos sobre esto, considerando además que el paciente de más edad con LMC ya es vulnerable a la osteoporosis. Por ende, solo se puede concluir que cada diabético tipo 2 y con LMC tendría que ser evaluado individualmente.
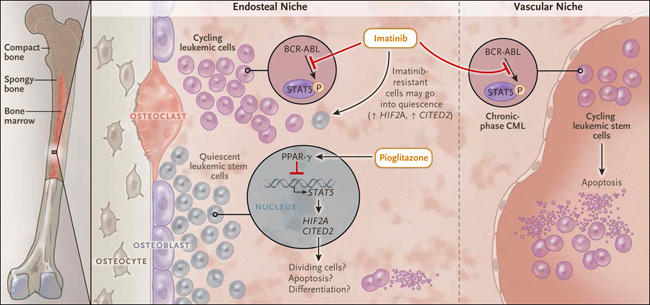
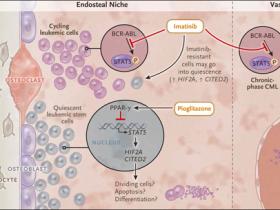
Figura 1: combatiendo células de la leucemia mieloide crónica (LMC)
Una vía molecular que involucra al receptor-γ activado por proliferador de peroxisomas (PPAR-γ) y sus moléculas efectoras río abajo – los factores de transcripción STAT5 y HIF-2α y la proteína reguladora CITED2 involucrados en el mantenimiento de un fenotipo quiescente de las células madre leucémicas - es blanco complementario de imatinib y de pioglitazona. El primero, previene la activación de la fosforilación y por lo tanto la activación de la proteína STAT5 mediado por BCR-ABL en células LMC capaces de dividirse, haciendo que las células sean susceptibles a la apoptosis; también puede inducir a las células madre leucémicas para entrar en un estado de reposo. Imatinib también debería matar cualquier célula de leucemia en fase crónica que se esté dividiendo activamente en espacios vasculares. La Pioglitazona actúa como un represor transcripcional de STAT5 debido a su papel como un agonista de PPAR-γ. Como consecuencia, las células madre leucémicas son inducidas a proliferar (y por lo tanto son susceptibles a imatinib), a someterse a apoptosis, o posiblemente a diferenciarse en otro tipo celular, como un osteoclasto. Otra posibilidad teórica es que los agonistas de PPAR-γ también favorezcan la proliferación induciendo la formación de nuevos adipocitos en nichos de células troncales leucémicas.
El tratamiento no evaluado con tiazolidinedionas, de las tres cuartas partes restantes de los pacientes con LMC y tolerancia normal a la glucosa, que no son candidatos a agentes antiglicémicos, tendrían el mismo riesgo de efectos secundarios de las personas con diabetes. Es común en los diabéticos tipo 2 que toman tiazolidinedionas que sufran un aumento de peso (y a veces mucho) como consecuencia de la formación de nuevos adipocitos. Es altamente probable que pueda ocurrir un efecto similar en al menos algunos individuos con LMC no diabéticos, colocando así una carga adicional sobre las condiciones coexistentes. En el lado positivo, en pacientes sin diabetes, las tiazolidinedionas podrían ser retiradas si se logra una respuesta molecular completa. Además, es posible que las dosis de tiazolidinedionas inferiores a las requeridas para el tratamiento de la hiperglucemia en diabéticos tipo 2, puedan ser eficaces en casos de LMC. Sin embargo, también es posible que sean necesarias dosis mayores. Sin un estudio doble ciego, aleatorizado que incluya a pacientes con LMC, no se puede determinar cuál es la dosis o la duración terapéutica, y por otro lado, si no se consigue una respuesta molecular, los riesgos, beneficios y costos de esta respuesta sin una recuperación evidente tiene que ser sopesada.
Existen algunos puntos teóricos que vale la pena considerar. Como fue discutido en el trabajo de Prost y equipo, la mayoría de pacientes que reciben pioglitazona junto a imatinib no tenían una respuesta molecular completa, dentro del marco de tiempo del informe provisional, reflejando que el período para una respuesta de ese tipo parece ser prolongado. Cuando se utilizan las tiazolidinedionas, el aumento de peso ocurre dentro de semanas después del inicio del tratamiento, lo que sugiere que la inducción de la adipogénesis a través de la activación de PPAR-γ se produce en este rango temporal. Por lo tanto, es probable que in vivo existan mecanismos homeostáticos de forma de contrarrestar los efectos de las tiazolidinedionas sobre la represión transcripcional en células madre leucémicas así como en las hematopoyéticas. Adicionalmente, el hueso es relativamente carente de vascularización y puede tomar un lapso extendido de tiempo para evidenciar un efecto molecular, el que sería suficiente para la acumulación de pioglitazona en los nichos endo-óseos de células madre leucémicas.
Hipotéticamente, quienes padecen LMC y además tienen resistencia insulínica o diabetes tipo 2, pueden tener una respuesta diferente a la pioglitazona versus quienes no sufren las condiciones metabólicas. Agonistas de PPAR-γ se encuentran en etapas de ensayos clínicos para la quimioprevención y tratamiento de otros tipos de cáncer. Sin embargo, también se ha reportado un mayor riesgo de cáncer de vejiga en quienes reciben tiazolidinedionas: datos de informes provisionales de pruebas clínicas indicaron que 6 de 24 individuos descontinuaron el uso de pioglitazona dentro de 1 año después de comenzar el tratamiento debido a las advertencias emitidas por el Ministerio de Salud Francés, en relación a una asociación entre la terapia y este tipo de cáncer. En conclusión, la adición de las tiazolidinedionas a los regímenes de LMC en adultos mayores con o sin diabetes tipo 2 para ampliar la esperanza de una cura para la patología, requerirá la evaluación criteriosa caso por caso, por parte de un equipo médico multidisciplinario acerca del riesgo potencial y los beneficios.
Fuente bibliográfica
Targeting Stem Cells in Chronic Myeloid Leukemia with a PPAR-γ Agonist
Josephine M. Egan, M.D
Diabetes Section, Laboratory of Clinical Investigation, National Institute on Aging, National Institutes of Health, Baltimore
DOI: 10.1056/NEJMcibr1511276